
| A、青霉素 | B、阿司匹林 |
| C、麻黄碱 | D、抗酸药 |
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将金属钠保存在汽油中 |
| B、氢氟酸可保存在橡胶塞的玻璃试剂瓶中 |
| C、烧碱溶液用带磨口玻璃塞的试剂瓶保存 |
| D、水玻璃保存在橡胶塞的玻璃试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | C | D |
| 性质 结构 信息 | 室温下单质呈粉末状固体,加热易熔化.单质在空气中燃烧,发出明亮的蓝紫色火焰. | 单质常温、常压下是气体,能溶于水.原子的M层p轨道有1个未成对的电子 | 单质质软、银白色固体、导电性强.单质在空气中燃烧发出黄色的火焰. | 原子最外层电子层上s电子数等于p电子数.单质是一种重要的半导体材料. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5:2 | B、4:3 |
| C、2:7 | D、7:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
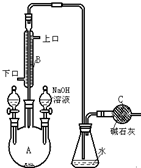 制备溴苯的实验装置如图所示,请回答下列问题:
制备溴苯的实验装置如图所示,请回答下列问题: +Br+→[
+Br+→[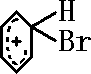 ];[
];[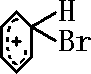 ]+FeBr4-→
]+FeBr4-→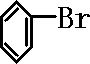 +HBr+FeBr3;
+HBr+FeBr3; +Br2→
+Br2→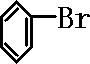 +HBr中的催化剂为
+HBr中的催化剂为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com