
【题目】鉴别氯化铁溶液与氢氧化铁胶体最简便的方法是( )
A.萃取
B.蒸馏
C.过滤
D.丁达尔效应
 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】常温下,三种难溶电解质的溶度积如下表。
物质 | Ag2CrO4 | AgCl | AgBr |
Ksp | 1.0×10-12 | 1.8×10-10 | 7.7×10-13 |
下列说法正确的是
A. 向饱和AgCl溶液中通入少量HCl气体,溶液中c(Ag+)不变
B. 浓度均为1×10-6 molL﹣1的AgNO3、HBr溶液等体积混合后会生成AgBr沉淀
C. 常温下,以0.01 molL﹣1 AgNO3溶液滴定20mL0.01molL﹣1KCl和0.01molL﹣1K2CrO4的混合溶液,CrO42-先沉淀
D. 常温下,Ag2CrO4(s)+2Cl-(aq)![]() 2AgCl(s)+CrO42-(aq)的平衡常数K=3.1×107
2AgCl(s)+CrO42-(aq)的平衡常数K=3.1×107
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的液态化合物XY2,在一定量的O2中恰好完全燃烧,反应方程式为XY2(l)+3O2(g)﹦XO2(g)+2YO2(g),冷却后,在标准状况下测得生成物的体积是672 mL,密度是2.56 g·L-1。
(1)反应前O2的体积是________mL(标准状况下)。
(2)化合物XY2的摩尔质量是________。
(3)若XY2分子中X、Y两元素质量比是3:16,则X、Y两元素分别是________和________(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.1 mol/L的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是( )
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是( )
A. 加少量烧碱溶液 B. 加入少量CH3COONa晶体
C. 加少量冰醋酸 D. 加水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示细胞内某些有机物的元素组成和功能关系,其中A、B代表元素,Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ是细胞中重要的有机化合物,X、Y、Z、P是构成生物大分子的基本单位。回答下列问题:
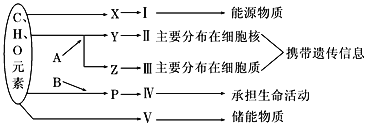
(1)图中A代表的元素是________,B代表的元素是_______。(用元素符号填写)
(2)Ⅰ在小麦种子中主要指__________。Ⅱ和Ⅲ统称为_______。
(3)鉴别细胞中Ⅱ、Ⅲ的分布,使用的试剂是________________________________,Ⅱ染色后颜色呈现________色。本实验需用盐酸处理细胞,盐酸的作用是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示与对应叙述相符的是

A. 图甲表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS)>Ksp(CuS)
B. 图乙表示pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
C. 图丙表示用0.1000 mol·L-lNaOH溶液滴定25.00 mL盐酸的滴定曲线,则 c(HCl)=0.0800 mol ·L-1
D. 图丁表示反应N2(g)+3H2(g) ![]() 2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铝片和铜片用导线相连,一组插入浓HNO3溶液中,一组插入稀NaOH溶液中,分别形成了原电池,则在这两个原电池中,正极分别为( )
A.铜片、铝片B.铝片、铜片C.铝片、铝片D.铜片、铜片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定实验是化学学科中最重要的定量实验之一。常见的滴定实验有酸碱中和滴定、氧化还原反应滴定、沉淀滴定等等。
(1)酸碱中和滴定——用0.1000mol/LHCl标准溶液测定某NaOH溶液的物质的量浓度(用酚酞作指示剂),做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol/LHCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 25.01 |
2 | 25.00 | 1.56 | 26.56 |
3 | 25.00 | 0.21 | 25.20 |
计算出待测NaOH溶液的物质的量浓度为_____________________________(小数点后保留四位)。
(2)氧化还原滴定——葡萄酒中抗氧化剂残留量的测定,葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

注:实验中加入盐酸的目的是将Na2S2O5全部转化成SO2;滴定过程中发生的反应是:I2 + SO2 + 2H2O ![]() 2HI + H2SO4
2HI + H2SO4
①滴定时,I2溶液应装在__________(“酸”或“碱”)式滴定管中,判断滴定终点的方法是:当滴入最后一滴碘溶液时,溶液由_________________________,且保持30s不变。
②实验消耗标准I2溶液25.00mL,所测样品中抗氧化剂的残留量(以游离SO2计算)为___________g/L。
③下列情形会造成测定结果偏高的是_____________。
A.滴定持续时间稍长,溶液中部分HI被空气氧化 B.滴定前平视,滴定后俯视
C.盛装标准I2溶液的滴定管用蒸馏水洗净后,未润洗
D.滴定前滴定管尖嘴有气泡,滴定后气泡消失
(3)沉淀滴定——滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是_____________(填选项字母)。
难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
A.NaCl B.NaBr C.NaCN D.Na2CrO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com