
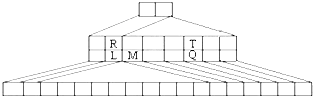
 如图是另一种元素周期表--三角形元素周期表的一部分,图中标示了L、M、Q、R、T元素的位置,下列判断正确的是:( )
如图是另一种元素周期表--三角形元素周期表的一部分,图中标示了L、M、Q、R、T元素的位置,下列判断正确的是:( )| A、Q、T两元素的氢化物的稳定性为HnT<HnQ |
| B、L、R的单质与盐酸反应速率为R>L |
| C、M与T形成的化合物有两性 |
| D、L、Q形成的简单离子核外电子数相等 |


 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
A、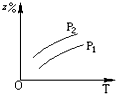 |
B、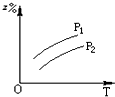 |
C、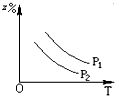 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在电解池的阴极发生还原反应 |
| B、与电源负极相连的是电解池的阳极 |
| C、阴离子移向电解池的阳极 |
| D、电子从电源的负极沿导线流入电解池的阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增大反应物浓度,活化分子百分数增大,化学反应速率增大 |
| B、难溶物质可能为强电解质,如BaSO4是强电解质 |
| C、放热反应的反应速率总是大于吸热反应的反应速率 |
| D、KW随浓度的改变而改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2g | B、1.6g |
| C、1g | D、1.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:
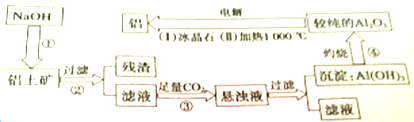
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用碱式滴定管向锥形瓶内注入10mL氢氧化钠溶液,若开始时滴定管尖嘴有气泡,则测定结果偏高 |
| B、边滴边振荡,直到溶液由橙色变成黄色且半分钟内不褪色为止 |
| C、接近滴定终点时,往锥形瓶加入少量蒸馏水,则测定结果偏高 |
| D、用酸式滴定管时,起始读数俯视,结束读数仰视,则测定结果偏高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com