
【题目】下列现象与胶体的性质无关的是 ( )
A. 夏日的傍晚常常看到万丈霞光穿云而过美不胜收
B. 过滤除去氯化钠溶液中的泥沙
C. 食品加工厂利用豆浆中加入盐卤做豆腐
D. 化工厂利用静电除尘技术去除废气中的固体悬浮物
科目:高中化学 来源: 题型:
【题目】判断下列盐溶液的酸碱性,能发生水解的用离子方程式表示,不能发生水解的请写上“不发生水解”字样.K2CO3溶液呈性;
K2SO4溶液呈性;
FeCl3溶液呈性 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水系锂电池具有安全、环保和价格低廉等优点成为当前电池研究领域的热点.以钒酸钠(NaV3O8)为正极材料的电极反应式为:NaV3O8+xLi++xe﹣═NaLixV3O8 , 则下列说法不正确的是( ) 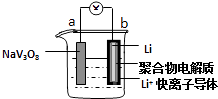
A.放电时,该电池的总反应为:xLi+NaV3O8═NaLixV3O8
B.充电过程中Li+从阳极向阴极迁移
C.充电过程中阳极的电极反应式为NaLixV3O8﹣xe﹣═NaV3O8+xLi+ , NaLixV3O8中钒的化合价发生变化
D.该电池可以用硫酸钠溶液作电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是一种重要的化工原料,工业上生产硝酸的过程如下:
(1)以氮气、氢气为原料合成氨①下列措施可以提高H2的转化率是(填选项序号) .
a.选择适当的催化剂 b.增大压强 c.及时分离生成的NH3d.升高温度
②一定温度下,在密闭容器中充入1molN2和3molH2发生反应.若容器容积恒定,达到平衡状态时,容器内的压强是原来的 ![]() ,则N2的转化率a1=;
,则N2的转化率a1=;
若容器压强恒定,达到平衡状态时,N2的转化率为a2 , 则a2a1(填“>”、“<”或“=”)
(2)以氨气、空气为主要原料制硝酸.在容积恒定的密闭容器中进行反应2NO(g)+O2(g)2NO2(g)△H>0
该反应的反应速率(v)随时间(t)变化的关系如下图所示.若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号) . 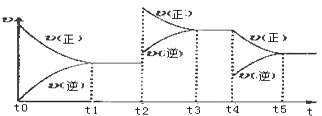
a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0~t5时,容器内NO2的体积分数在t3时值的最大
(3)硝酸厂常用如下2种方法处理尾气.①催化还原法:催化剂存在时用H2将NO2还原为N2 .
已知:2H2(g)+O2(g)=2H2O(g)△H=﹣483.6kJ/mol
N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是 .
②碱液吸收法:用Na2CO3溶液吸收NO2生成CO2 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题: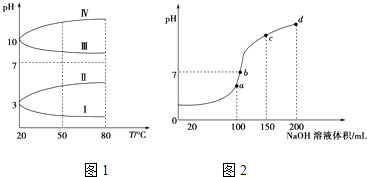
(1)NH4Al(SO4)2可作净水剂,其理由是(用必要的化学用语和相关文字说明).
(2)如图1是0.1molL﹣1电解质溶液的pH随温度变化的图象.①其中符合0.1molL﹣1NH4Al(SO4)2的pH随温度变化的曲线是(填写序号);
②20℃时,0.1molL﹣1NH4Al(SO4)2中2c(SO ![]() )﹣c(NH
)﹣c(NH ![]() )﹣3c(Al3+)=(要求填精确的表达式)
)﹣3c(Al3+)=(要求填精确的表达式)
(3)室温时,向100mL 0.1molL﹣1NH4HSO4溶液中滴加0.1molL﹣1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图2所示:试分析图中a、b、c、d四个点,水的电离程度最大的是;在b点,溶液中各离子浓度由大到小的排列顺序是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示。
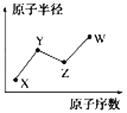
已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1。请回答下列问题:
(1)写出四种元素的元素符号:W________;X________;Y________;Z________。
(2)四种元素的所有化合价中,最低负化合价为________价,最高正化合价为________价。
(3)甲和乙分别是由W、X、Y、Z四种元素中的三种元素组成的常见化合物,化合物甲具有消毒杀菌作用,其化学式为________;化合物乙是一种常见的化肥,其化学式为________。
(4)HYO3的酸性比HWO强,有人据此认为Y的非金属性强于W,你认为这种看法是否正确,说明理由:________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素,周期表的全部元素中X的原子半径最小,X与R的最外层电子数相等;Z的内层电子数是最外层电子数的一半,U的最高化合价和最低化合物的代数和为6;R和Q可形原子数之比为1:1和2:1的两种化合物;R、T、U三者的最高价氧化物对应的水化物两两之间能发生化学反应.请回答下列问题:
(1)T元素在期表中的位置是________;由上述元素中的四种元素形成的既含有离子键又含有共价键的化合物为________(写出其中一种物质的名称).
(2)X、Z、Q三种元素的原子半径由小到大顺序为________(填元素符号).
(3)T、U两元素最高价氧化物对应的水化物反应的离子方程式为________.
(4)下列可以判断R和T金属性强弱的是________(填序号).
a.单质的熔点R比T低 b.单质与酸反应时,失电子数R比T少
c.单质与水反应R比T剧烈 d.最高价氧化物的水化物的碱性R比T强
(5)某同学用Q、R两元素的单质反应生成固体物质R2Q2,R2Q2属于离子化合物,且能与化合物X2Q反应生成Q的单质.R2Q2的电子式为________;R2Q2与X2Q反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题: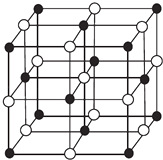
(1)写出C、D、E三种原子第一电离能由大到小的顺序为 . (用元素符号表示)
(2)A原子与B、C、D原子形成最简单化合物的稳定性由强到弱的顺序为(用分子式表示),根据价层电子对互斥理论预测BA2D的分子构型为 .
(3)某蓝色晶体,其结构特点是X2+、X3+离子分别占据六面体互不相邻的顶点,而六面体的每条棱上均有一个BC﹣ . 与A同族且相隔两个周期的元素R的离子位于立方体的恰当位置上.根据其结构特点可知该晶体的化学式为(用最简正整数表示) .
(4)科学家通过X射线探明,KCl、MgO、CaO、TiN的晶体结构与NaCl的晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
离子晶体 | NaCl | KCl | CaO |
晶格能/kJmol﹣1 | 786 | 715 | 3401 |
根据表格中的数据:判断KCl、MgO、TiN三种离子晶体熔点从高到低的顺序是 . MgO晶体中一个Mg2+周围和它最邻近且等距离的O2﹣有个.
(5)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和Cr2O3中,适合作录音带磁粉原料的是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com