
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题: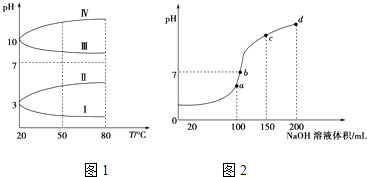
(1)NH4Al(SO4)2可作净水剂,其理由是(用必要的化学用语和相关文字说明).
(2)如图1是0.1molL﹣1电解质溶液的pH随温度变化的图象.①其中符合0.1molL﹣1NH4Al(SO4)2的pH随温度变化的曲线是(填写序号);
②20℃时,0.1molL﹣1NH4Al(SO4)2中2c(SO ![]() )﹣c(NH
)﹣c(NH ![]() )﹣3c(Al3+)=(要求填精确的表达式)
)﹣3c(Al3+)=(要求填精确的表达式)
(3)室温时,向100mL 0.1molL﹣1NH4HSO4溶液中滴加0.1molL﹣1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图2所示:试分析图中a、b、c、d四个点,水的电离程度最大的是;在b点,溶液中各离子浓度由大到小的排列顺序是 .
【答案】
(1)Al3+水解生成的Al(OH)3具有吸附性,即Al3++3H2O═Al(OH)3+3H+ , Al(OH)3吸附悬浮颗粒使其沉降从而净化水
(2)Ⅰ;10﹣3 mol?L﹣1
(3)a;c(Na+)>c(SO ![]() )>c(NH
)>c(NH ![]() )>c(OH﹣)=c(H+)
)>c(OH﹣)=c(H+)
【解析】解:(1)Al3+水解生成的Al(OH)3具有吸附性,离子方程式:Al3++3H2O═Al(OH)3+3H+ , Al(OH)3 , 所以答案是:Al3+水解生成的Al(OH)3具有吸附性,即Al3++3H2O═Al(OH)3+3H+ , Al(OH)3吸附悬浮颗粒使其沉降从而净化水;(2)①NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大,pH减小,符合的曲线为Ⅰ,所以答案是:1;②根据电荷守恒,可以求出2c(SO ![]() )﹣c(NH
)﹣c(NH ![]() )﹣3c(Al3+)=c(H+)﹣c(OH﹣)=10﹣3 molL﹣1[c(OH﹣)太小,可忽略],所以答案是:10﹣3 molL﹣1;(3)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+ , 溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3H2O,(NH4)2SO4可以促进水的电离,而NH3H2O抑制水的电离.b点溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3H2O三种成分,a点时c(Na+)=c(SO
)﹣3c(Al3+)=c(H+)﹣c(OH﹣)=10﹣3 molL﹣1[c(OH﹣)太小,可忽略],所以答案是:10﹣3 molL﹣1;(3)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+ , 溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3H2O,(NH4)2SO4可以促进水的电离,而NH3H2O抑制水的电离.b点溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3H2O三种成分,a点时c(Na+)=c(SO ![]() ),b点时c(Na+)>c(SO
),b点时c(Na+)>c(SO ![]() ),根据N元素与S元素的关系,可以得出c(SO
),根据N元素与S元素的关系,可以得出c(SO ![]() )>c(NH
)>c(NH ![]() ),故c(Na+)>c(SO
),故c(Na+)>c(SO ![]() )>c(NH
)>c(NH ![]() )>c(OH﹣)=c(H+), 所以答案是:a;c(Na+)>c(SO
)>c(OH﹣)=c(H+), 所以答案是:a;c(Na+)>c(SO ![]() )>c(NH
)>c(NH ![]() )>c(OH﹣)=c(H+).
)>c(OH﹣)=c(H+).


科目:高中化学 来源: 题型:
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示: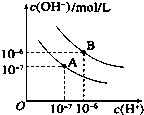
(1)则25℃时水的电离平衡曲线应为(填“A”或“B”),请说明理由
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生命健康密切相关,“84”消毒液(有效成分为 NaClO)在抗击新冠肺炎疫情中起到重要作用。下列说法错误的是
A.“84”消毒液为混合物
B.“84”消毒液具有漂白性
C.“84”消毒液可用于灭杀新型冠状病毒
D.“84”消毒液可以与“洁厕灵”(主要成分为盐酸)混用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大。A和C同族,B和D同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成离子化合物,其阴阳离子个数比为1∶1。
回答下列问题:
(1)五种元素中非金属性最强的是_______________(填元素符号)。
(2)由A和B、D、E所形成的共价化合物中,热稳定性最差的是_______________(用化学工表示)。
(3)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为_______________,其中存在的化学键类型为____________________。
(4)D的最高价氧化物的水化物的化学式为____________________。
(5)由A和B形成的一种气体在工业上用途很广。其工业制法的方程式为:__________;实验室制取的方程式为____________________。
(6)单质E与水反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象与胶体的性质无关的是 ( )
A. 夏日的傍晚常常看到万丈霞光穿云而过美不胜收
B. 过滤除去氯化钠溶液中的泥沙
C. 食品加工厂利用豆浆中加入盐卤做豆腐
D. 化工厂利用静电除尘技术去除废气中的固体悬浮物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三草酸合铁酸钾晶体(K3[Fe(C2O4)3]xH2O)是一种光敏材料,在110℃可完全失去结晶水.为测定该晶体中铁的含量,某实验小组做了如下实验:铁含量的测定
步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250mL溶液.
步骤二:取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO ![]() 被还原成Mn2+ . 向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性.
被还原成Mn2+ . 向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性.
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO ![]() 被还原成Mn2+ . 重复步骤二、步骤三操作,滴定消耗0.010mol/L KMnO4溶液分别为19.98mL和20.00mL.请回答下列问题:
被还原成Mn2+ . 重复步骤二、步骤三操作,滴定消耗0.010mol/L KMnO4溶液分别为19.98mL和20.00mL.请回答下列问题:
(1)滴定过程中,高锰酸钾应盛装在滴定管中(填“酸式”或“碱式”).
(2)用离子方程式表示步骤二中涉及到的相关化学反应:;Zn+2Fe3+═2Fe2++Zn2+ .
(3)步骤三中滴定终点的判定: .
(4)在步骤二中,若加入的KMnO4溶液的量不够,则测得的铁含量 . 在步骤三中,若滴定前仰视读数,滴定后俯视读数,则测得的铁含量 . (选填“偏低”、“偏高”、“不变”)
(5)实验测得该晶体中铁的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】文房四宝即笔、墨、纸、砚,其中以湖笔、徽墨、宣纸和端砚最为称著。下列说法正确的是
A.徽墨中墨的主要成分是黑色的油脂B.湖笔中笔头的羊毫的主要成分是蛋白质
C.宣纸的主要成分是无机碳和少量的纤维素D.含较多氧化铁的端砚呈黑色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,体积均为0.25 L 的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)2NH3(g)△H=﹣92.6 kJ/mol.实验测得起始、平衡时数据如下表( )
容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15kJ |
② | 0.8 | 2.4 | 0.4 | 放出热量:Q |
A.容器①、②中反应的平衡常数相等,平衡时氮气的转化率相等
B.平衡时,两个容器中NH3 的体积分数均为1/8
C.容器②中达平衡时放出的热量Q=4.63 kJ
D.若容器①改为恒压体系,充入0.25 L He,则平衡时放出的热量大于23.15 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com