
【题目】相同温度下,体积均为0.25 L 的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)2NH3(g)△H=﹣92.6 kJ/mol.实验测得起始、平衡时数据如下表( )
容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15kJ |
② | 0.8 | 2.4 | 0.4 | 放出热量:Q |
A.容器①、②中反应的平衡常数相等,平衡时氮气的转化率相等
B.平衡时,两个容器中NH3 的体积分数均为1/8
C.容器②中达平衡时放出的热量Q=4.63 kJ
D.若容器①改为恒压体系,充入0.25 L He,则平衡时放出的热量大于23.15 kJ
【答案】C
【解析】解:A、平衡常数只与温度有关,相同温度下,体积均为0.25L的两个恒容密闭容器中发生相同的反应,则平衡常数应相同,①②是等效平衡,但①起始氮气的物质的量大,所以转化率小,故A错误;B、①容器中放出23.15kJ热量,则生成氨气的物质的量为: ![]() =0.5mol,利用三段式法计算:
=0.5mol,利用三段式法计算:
N2(g)+3H2(g)2NH3(g)△H=一92.6kJ/mol
起始:1mol 3mol 0
转化:0.25mol 0.75mol 0.5mol
平衡:0.75mol 2.25mol 0.5mol
平衡时,①容器中NH3的体积分数等于气体的物质的量分数 ![]() =
= ![]() ,从等效平衡的角度分析,0.9molN2、2.7molH2和0.2molNH3相当于1molN2、3molH2 , 在相同条件下处于相同平衡状态,所以平衡时两个容器内氨气的体积分数相等,故B错误;
,从等效平衡的角度分析,0.9molN2、2.7molH2和0.2molNH3相当于1molN2、3molH2 , 在相同条件下处于相同平衡状态,所以平衡时两个容器内氨气的体积分数相等,故B错误;
C、②平衡时生成0.1mol的氨气,而生成2mol的氨气放出热量为: ![]() =4.63 kJ,故C正确;
=4.63 kJ,故C正确;
D、若若容器①改为恒压体系,充入0.25 L He,相当于在原来的基础上减小压强,平衡逆向移动,平衡时放出的热量小于23.15kJ,故D错误;
故选C.
【考点精析】解答此题的关键在于理解化学平衡状态本质及特征的相关知识,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).


科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题: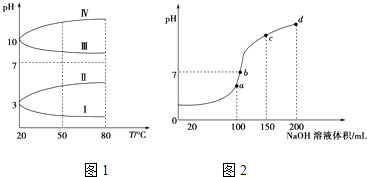
(1)NH4Al(SO4)2可作净水剂,其理由是(用必要的化学用语和相关文字说明).
(2)如图1是0.1molL﹣1电解质溶液的pH随温度变化的图象.①其中符合0.1molL﹣1NH4Al(SO4)2的pH随温度变化的曲线是(填写序号);
②20℃时,0.1molL﹣1NH4Al(SO4)2中2c(SO ![]() )﹣c(NH
)﹣c(NH ![]() )﹣3c(Al3+)=(要求填精确的表达式)
)﹣3c(Al3+)=(要求填精确的表达式)
(3)室温时,向100mL 0.1molL﹣1NH4HSO4溶液中滴加0.1molL﹣1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图2所示:试分析图中a、b、c、d四个点,水的电离程度最大的是;在b点,溶液中各离子浓度由大到小的排列顺序是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中错误的有
A. 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B. 蒸馏时,应使温度计的水银球靠近蒸馏烧瓶的瓶底
C. 过滤时,玻璃棒下端在引流过程中应靠在三层滤纸处
D. 称量时,称量物放在纸上置于托盘天平左盘,砝码直接放在天平右盘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,PbO2 与Cr3+反应,产物是Cr2O72-和Pb2+,则与5molCr3+反应所需PbO2的物质的量为
A. 7.5mol B. 1.5mol C. 3mol D. 3.25mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对原子、分子进行操纵的纳米超分子技术往往能实现意想不到的变化。如纳米铜颗粒一遇到空气就会剧烈燃烧,甚至发生爆炸。若将纳米铜均匀地分散到蒸馏水中,所形成的物质( )
A. 溶液B. 胶体C. 悬浊液D. 乳浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】平达喜是一种常用抗酸药,其主要成分是由短周期元素组成的化合物X,式量为602.甲同学欲探究X的组成.查阅资料:
①由短周期元素组成的抗酸药的有效成分有碳酸氢钠、碳酸镁、氢氧化铝、硅酸镁铝、碱式碳酸镁铝(或结晶水合物).
②Al3+在pH=5.0时沉淀完全;Mg2+在pH=8.8时开始沉淀,在pH=11.4时沉淀完全.
实验过程:
Ⅰ.向一定量的X粉末中加入45.0 mL的2mol/L盐酸溶液中,恰好完全反应并收集到112 mL(标准状况下)的A气体,A气体可使澄清石灰水变浑浊.
Ⅱ.用铂丝蘸取少量Ⅰ中所得的溶液,在火焰上灼烧,无黄色火焰.
Ⅲ.向Ⅰ中所得的溶液中滴加氨水,调节pH至5~6,产生白色沉淀B,过滤.
Ⅳ.向沉淀B中加过量NaOH溶液,沉淀全部溶解.
Ⅴ.向Ⅲ中得到的滤液中滴加NaOH溶液,调节pH至12,得到白色沉淀C.沉淀物进行洗涤干燥后重1.74 g.
(1)A的电子式是 .
(2)由Ⅰ中可确定X中存在两种带负电荷的原子团及个数比 .
(3)由Ⅰ判断X一定不含有的元素是 .
(4)Ⅲ中生成B的离子方程式是 .
(5)Ⅳ中B溶解的化学方程式是 .
(6)沉淀C的化学式是 .
(7)若X中n(B):n(C)=1:3,则X的化学式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中有关物质的浓度关系正确的是( )
A.c(NH ![]() )相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c[(NH4)2SO4]>c(NH4Cl)
)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c[(NH4)2SO4]>c(NH4Cl)
B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)
C.1.0 mol/L Na2CO3溶液:c(OH﹣)=c(HCO ![]() )+c(H+)+2c(H2CO3)
)+c(H+)+2c(H2CO3)
D.某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH﹣)+c(HA﹣)+c(A2﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2 表示逆反应的活化能).下列有关叙述正确的是( ) 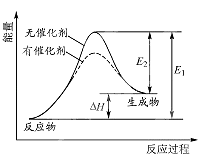
A.该反应为放热反应
B.催化剂能改变该反应的焓变
C.催化剂能降低该反应的活化能
D.逆反应的活化能大于正反应的活化能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com