
【题目】将氨水缓缓地滴入盐酸中至中性,下列有关的说法正确的是
①盐酸过量②氨水过量③恰好完全反应④c(NH4+)=c(Cl-)⑤c(NH4+)<c(Cl-)
A.①⑤ B.③④ C.②⑤ D.②④
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 铁粉溶于稀盐酸:2Fe+6H+=2Fe3++3H2↑
B. 碳酸钙溶于稀盐酸:CO32-+2H+=CO2↑+H2O
C. 氧化铜溶于醋酸:CuO+2CH3COOH =Cu2+ +2CH3COO- +H2O
D. 硫酸铜与氢氧化钡溶液混合:Ba2++SO42-=BaSO4 ↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将6 mol H2和3 mol CO充入容积为0.5 L的密闭容器中,进行如下反应:
2H2(g)+CO(g)![]() CH3OH(g),6秒末时容器内压强为开始时的0.6倍。
CH3OH(g),6秒末时容器内压强为开始时的0.6倍。
试计算:(1)H2的反应速率是多少?(2)CO的转化率为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物甲中含有明矾KAl(SO4)2·12H2O、Al2O3和Fe2O3。在一定条件下由甲可实现下图所示的物质之间的转化。
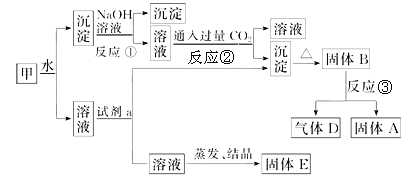
请回答下列问题:
(1)写出A、B的化学式:A______;B_____。
试剂a最好选用______________(填序号),写出反应的离子方程式:_________。
(2)除去固体A中混有的镁选用__________(填序号),写出反应的化学方程式:___________。
a.NaOH溶液 b.稀盐酸 c.二氧化碳 d.氨水
(3)写出反应②的离子方程式:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向0.1 mol·L-1的硫酸溶液中逐渐加入物质的量浓度相同的的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验时不同阶段的溶液,下列有关说法中不正确的是
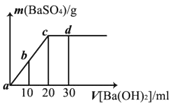
A.溶液的pH:a<b<c<d B.溶液的导电能力:a>b>d>c
C.a、b溶液呈酸性 D.c、d溶液呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pOH= -lgc(OH-)。298 K时,向20.00 mL0.10mol·L-1氨水中滴入0.10 mol·L-1的盐酸,溶液的pH和pOH与加入盐酸体积关系如图所示。下列说法正确的是
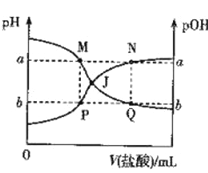
A. 曲线PJN表示溶液中PH的变化
B. M点水的电离程度比Q点大
C. M、P两点的数值之和a + b = 14
D. pH与pOH交叉点J对应的V(盐酸)=20.00 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X和H是固体,B和G是液体,其余均为气体,1 mol X分解得到A、B、C各1 mol。
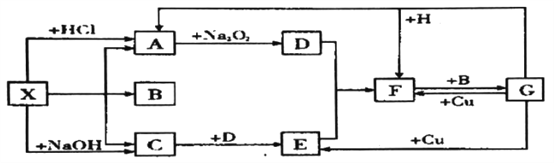
试回答下列各题:
(1)写出下列物质的化学式:X______,B_________。
(2)写出下列反应的化学方程式:
①G+H→A+F:____________________;
②C+D→E:________________。
(3) 写出下列反应的离子方程式:
G+Cu→E:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是最常见的金属材料。铁能形成[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(III)〕 和Fe(CO)x等多种配合物。
(1)基态Fe3+的核外电子排布式为_____,与NO3-互为等电子体的分子是__________。
(2)尿素(H2NCONH2)分子中C、N原子的杂化方式依次为______。C、N、O三种元素的第一电离能由大到小的顺序是______。
(3)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=______。Fe(CO)x常温下呈液态,熔点为-20 .5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于_______(填晶体类型)。
(4)铁有δ、γ、a三种同素异形体,δ、γ、a三种晶胞中铁原子的配位数之比为_______。
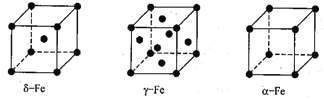
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜灰渣(含有Cu、Zn、CuO、ZnO及少量的FeO、Fe2O3)生产硝酸铜溶液的流程如下:
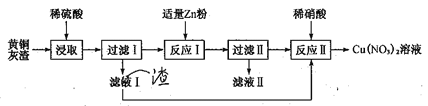
(1)写出酸浸时Fe2O3和稀硫酸反应的离子方程式:_________________。
(2)反应I中所加Zn不能过量的原因是________________。
(3)滤液II中含有的金属阳离子主要有_____________。
(4)写出反应II的离子方程式:______________。反应II应控制温度不能过高也不能过低的原因是___________________。
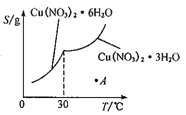
(5)已知Cu(NO3)2·6H2O和Cu(NO3)2·3H2O的溶解度随温度的变化如图所示。则由A点对应的溶液获取Cu(NO3)2·3H2O的方法是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com