
【题目】常温下,向0.1 mol·L-1的硫酸溶液中逐渐加入物质的量浓度相同的的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验时不同阶段的溶液,下列有关说法中不正确的是
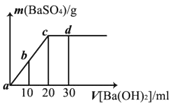
A.溶液的pH:a<b<c<d B.溶液的导电能力:a>b>d>c
C.a、b溶液呈酸性 D.c、d溶液呈碱性
【答案】D
【解析】
试题分析:硫酸和氢氧化钡反应方程式为Ba2++2OH-+SO42-+2H+=BaSO4↓+2H2O,根据方程式知,随着反应的进行,溶液中离子浓度逐渐减小直至其完全反应。A.硫酸溶液呈酸性,随着氢氧化钡的加入,溶液中氢离子浓度逐渐减小,pH逐渐增大,所以溶液的pH:a<b<c<d,故A正确;B.溶液导电能力与离子浓度成正比,溶液中离子浓度先减小后增大,所以溶液导电能力先减小后增大,溶液导电能力为a>b>d>c,故B正确;C.硫酸溶液呈酸性,随着氢氧化钡的加入,溶液中氢离子浓度逐渐减小,酸性减弱,a、b点碱不足量,所以溶液呈酸性,故C正确;D.c点酸碱恰好反应生成硫酸钡和水,d点氢氧化钡过量,所以c溶液呈中性、d溶液呈碱性,故D错误;故选D。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】25℃时,向盛有50mL pH=2的HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示。下列叙述正确的是( )
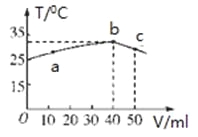
A. HA溶液的物质的量浓度为0.0l mol·L—1
B. b→c的过程中,温度降低的原因是溶液中发生了吸热反应
C. a→b的过程中,混合溶液中可能存在:c(A-)=c(Na+)
D. 25℃时,HA的电离平衡常数K约为1.43×10—2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,某平衡体系中含有X、Y、Z、W四种物质,此温度下发生反应的平衡常数表达式为:K=![]() ,有关该平衡体系的说法正确的是( )
,有关该平衡体系的说法正确的是( )
A.当混合气体的平均相对分子质量保持不变时,反应达平衡
B.增大压强,各物质的浓度不变
C.升高温度,平衡常数K增大
D.增大X的量,平衡即可能正向移动,也可能逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是
A. 已知25℃时NH4CN溶液显碱性,则25℃时的电离平衡常数K(NH3·H2O)>K(HCN)
B. 由水电离出的c(H+)=10-12mol·L-1的溶液中:Na+、Ba2+、HCO3-、Cl-可以大量共存
C. 已知Ksp(AgCl)=1.56×10-10, Ksp(Ag2CrO4)=9.0×10-12。向含有Cl-、CrO42-且浓度均为0.010 mol·L-1溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,CrO42-先产生沉淀
D. 常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氨水缓缓地滴入盐酸中至中性,下列有关的说法正确的是
①盐酸过量②氨水过量③恰好完全反应④c(NH4+)=c(Cl-)⑤c(NH4+)<c(Cl-)
A.①⑤ B.③④ C.②⑤ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是
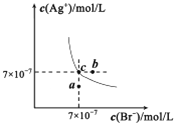
A.在t℃时,AgBr的Ksp为4.9×l0-13
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C.图中a点对应的是AgBr的不饱和溶液
D.在t℃时,AgCl(s)+Br-(aq) ![]() AgBr(s)+Cl-(aq)平衡常数K≈816
AgBr(s)+Cl-(aq)平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】未来可再生能源和清洁能源将成为人类利用新能源的主力军,下列关于能源的叙述正确的是( )
A.化石燃料是可再生能源
B.风能、太阳能是清洁能源
C.化石燃料都是清洁能源
D.氢能是不可再生的清洁能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水酸化将改变海水化学的种种平衡,使依赖于化学环境稳定性的多种海洋生物乃至生态系统面临巨大威胁。用生石灰中和法阻止海水酸化是人们的一种设想。生石灰属于( )
A.酸 B.碱 C.盐 D.氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com