
(1)(3分)一定温度下,向4L密闭容器中加入1molHI(g),发生2HI(g) H2(g)+I2(g),H2物质的量随时间的变化如图所示。0~2min内的平均反应速率v(HI)= mol/(L·min)。
H2(g)+I2(g),H2物质的量随时间的变化如图所示。0~2min内的平均反应速率v(HI)= mol/(L·min)。
(2)(3分)①某温度下,反应SO2(g)+ 1/2O2(g)  SO3 (g) 的平衡常数K1=50,在同一温度下,反应2SO3(g)
SO3 (g) 的平衡常数K1=50,在同一温度下,反应2SO3(g)  2SO2(g) + O2(g)的平衡常数K2的值为 。
2SO2(g) + O2(g)的平衡常数K2的值为 。
(3)(3分)某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g) 4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5∶4(相同的温度下测量)。则该反应的化学平衡常数:
4C(?)+2D(?)。反应一段时间后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为5∶4(相同的温度下测量)。则该反应的化学平衡常数:
K= 。(列出算式,代入数据即可)
(4)(7分)下图表示373K时,反应A(g)  2B(g)在前110s内的反应进程。
2B(g)在前110s内的反应进程。
①373K时反应进行到70s时,改变的条件可能是________,反应进行到90s时,改变的条件可能是_____。
| A.加入催化剂 | B.扩大容器体积 | C.升高温度 | D.增大A的浓度 |
(16分)
(1)(3分)0.025
(2)(3分)4×10-4
(3)(3分)0.16
(4)①B(2分) D(2分) ② 如下图(3分)
解析试题分析:(1)c(H2)="0.1" mol,HI反应了是0.2 mol, c(HI)=" 0.2" mol/4L="0.05" mol/L。 v(HI)="△c(HI)÷△t=0.05" mol/L ÷2min=0.025mol/(L·min)。
(2)K1=c(SO3)÷[c(SO2)×c(O2)1/2]=50,K2=[c(SO2)2×c(O2)] ÷c(SO3)2="(1/" K1)2="(1/" 50)2=4×10-4。
(3)3A(g)+2B(g)  4C(?)+2D(?)达到平衡反应的前后压强之比为5∶4,同温同体积条件下,物质的量之比等于压强之比,即n前∶n平=5∶4,说明这是个气体体积减少的反应,结合平衡前4 mol A和2 mol B,平衡时生成1.6 mol C分别讨论后只有C为固体或液体和D为气体满足条件,则该反应的化学平衡常数表达式是K=
4C(?)+2D(?)达到平衡反应的前后压强之比为5∶4,同温同体积条件下,物质的量之比等于压强之比,即n前∶n平=5∶4,说明这是个气体体积减少的反应,结合平衡前4 mol A和2 mol B,平衡时生成1.6 mol C分别讨论后只有C为固体或液体和D为气体满足条件,则该反应的化学平衡常数表达式是K=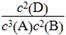 。平衡后生成c(D)=0.4mol/L,A、B剩余的浓度为c(A)=1.4mol/L,c(B)=0.6mol/L,带入数值,K=0.16。
。平衡后生成c(D)=0.4mol/L,A、B剩余的浓度为c(A)=1.4mol/L,c(B)=0.6mol/L,带入数值,K=0.16。
(4)①从图中分析到,B的浓度变化的很快,故373K时反应进行到70s时,改变的条件可能是扩大容器体积。反应进行到90s时的图像是B的浓度缓慢增加了,A的浓度减少了,故改变的条件可能是增大A的浓度。
考点:化学反应速率的计算 化学平衡常数的计算 化学平衡移动 图像分析
点评:本题考查的是化学反应速率的计算、化学平衡常数的计算、化学平衡移动和图像分析的相关知识,题目难度大,掌握好基础知识是解题的关键。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
 (2011?福建模拟)一定条件下铁可以和CO2发生反应:
(2011?福建模拟)一定条件下铁可以和CO2发生反应: FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0查看答案和解析>>
科目:高中化学 来源: 题型:
| c(CH3COO-)?c(H+) | c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2010?潍坊一模)铁元素及其化合物与人类的生产生活息息相关,
(2010?潍坊一模)铁元素及其化合物与人类的生产生活息息相关,| 1 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 动(填“向左”、“向右”或“不”).
动(填“向左”、“向右”或“不”).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com