
【题目】药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:

下列有关叙述正确的是
A.可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚
B.贝诺酯分子中有三种含氧官能团
C.乙酰水杨酸和对乙酰氨基酚均能与Na2CO3 溶液反应
D.贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚
科目:高中化学 来源: 题型:
【题目】研究表明:H2O2具有立体结构,两个氢原子像在一本半展开的书的两页纸上,两页纸面的夹角为94°,氧原子在书的夹缝上,O—H键与O—O键之间的夹角为97°。下列说法不正确的是( )

A. H2O2分子中既含极性键,又含非极性键
B. H2O2为极性分子
C. H2O2分子中的两个O原子均是sp3杂化
D. H2O2分子中既有σ键,又有π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是元素周期表中前36号元素,且原子序数依次增大。其相关信息如下表:
元素编号 | 元素性质或原子结构 |
X | X原子的最外层电子数是其内层电子总数的2倍 |
Y | Y的基态原子价电子排布式为nsnnpn+2 |
Z | 最外层中只有两对成对电子 |
W | 前四周期基态原子中,W元素的未成对电子数最多 |
(1)元素X最高价氧化物分子的空间构型是__________________,是_________(填“极性”或“非极性”)分子。
(2)Y的最简单氢化物的沸点比Z的最简单氢化物的沸点高,原因是____________________________________
(3)基态Z原子中,电子占据的最高电子层符号为_________,该电子层具有的原子轨道数为________________
(4)元素W位于元素周期表的第________族。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验需要450 mL 0.10 mol·L-1 Na2CO3溶液,某同学选用Na2CO3·10H2O晶体进行配制,简要回答下列问题:
(1)该实验应选择__________mL容量瓶。
(2)需称取Na2CO3·10H2O的质量为__________g。
(3)该实验的正确操作顺序是_______________(填字母代号)。
A.用托盘天平称取Na2CO3·10H2O晶体
B.上下颠倒摇匀
C.用胶头滴管加水至刻度线
D.洗涤所用仪器并将洗涤液转移进容量瓶
E.将所称取的晶体溶于蒸馏水并冷却至室温
F.将溶液转入容量瓶
(4)另需配制一定浓度的NaOH溶液,称量时若将NaOH固体置于滤纸上称量,则所配溶液浓度______;若容量瓶中有检漏时残留的少量蒸馏水,会使所配溶液浓度______;NaOH溶解后未经______;立即注入容量瓶至刻度线,会使浓度______;定容时必须使凹液面最低处与刻度线相切,若仰视会使所配溶液浓度______(凡涉及浓度变化填“偏高”、“偏低”或“无影响”)。
(5)向200 mL所配的 0.10 mol·L-1Na2CO3溶液中逐滴加入10 mL 12.25%稀H2SO4(ρ=1.0 g/cm3),理论上能收集到标准状况下的气体__________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1).2Na+2H2O=2NaOH+H2↑为氧化还原反应
氧化剂是_________ 还原剂是________
(2)在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3溶液,继续煮直至溶液呈____________色,即可制得Fe(OH)3胶体。
(3)Fe(OH)3胶体,插入两个惰性电极,通直流电一段时间,阴极附近的颜色逐渐变深,这种现象叫________;胶体中加入电解质,胶体变得浑浊,这是发生了__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中涉及的离子方程式书写正确的是( )
A. 向Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2OH-+2HCO![]() = CaCO3↓+CO
= CaCO3↓+CO![]() +2H2O
+2H2O
B. 室温下测得NH4HSO4溶液的pH<7,主要是因为存在:NH4++H2O![]() NH3·H2O+H3O+
NH3·H2O+H3O+
C. 用重铬酸钾溶液滴定草酸:Cr2O![]() +14H++3C2O
+14H++3C2O![]() -=2Cr3++6CO2↑+7H2O
-=2Cr3++6CO2↑+7H2O
D. 向AgCl沉淀中加入过量的氨水使AgCl溶解:AgCl+2NH3·H2O = [Ag(NH3)2]++Cl-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.10 mol·L-1盐酸分别滴定20.00 mL 0.10 mol·L-1氢氧化钾溶液和氨水,滴定过程中溶液pH随加入盐酸体积[V(HCl)]的变化关系如图所示。下列说法正确的是( )
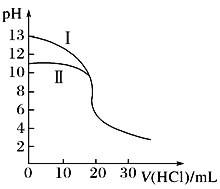
A. Ⅰ表示的是滴定氨水的曲线
B. 当pH=7时,滴定氨水消耗的V(HCl)<20 mL,且此时溶液中c(NH4+)=c(Cl-)
C. 滴定氢氧化钾溶液时,若V(HCl)>20 mL,则一定有:c(Cl-)>c(H+)>c(K+)>c(OH-)
D. 当滴定氨水消耗V(HCl)=10 mL时,c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含铬污泥主要含Cr2O3、Al2O3、Fe2O3等物质,该污泥可以用湿法回收利用,流程如下图所示:
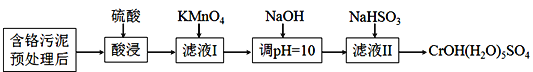
已知:室温下部分氢氧化物的Ksp见下表
Al(OH)3 | Fe(OH)3 | Cr(OH)3 | Mn(OH)2 | |
Ksp | 3×10-34 | 4×10-38 | 6×10-31 | 4×10-14 |
(1)酸浸前,对含铬污泥进行预处理即加水湿磨成浆体,湿磨的作用是_____________。
(2)向滤液I加KMnO4氧化Cr3+的离子方程式是________________________________;将Cr3+氧化的目的是____________________________________________________。
(3)室温下,调pH=10时, ![]() =_____;调溶液pH不能大于10,理由是_________。
=_____;调溶液pH不能大于10,理由是_________。
(4)NaHSO3在反应中的作用是___________;理论上n(NaHSO3):n[CrOH(H2O)5SO4]之比是_______________。
(5)NaHSO3固体在空气中易变质,写出检验NaHSO3是否变质的方法______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com