
【题目】依据有关信息解答下列化学实验问题:
(Ⅰ)醛类是重要的工业原料,可以跟亚硫酸氢钠饱和溶液反应,生成物是α﹣羟基磺酸钠(易溶于水,不溶于饱和亚硫酸氢钠溶液)R-CHO+NaHSO3![]() R-CH(OH)-SO3Na
R-CH(OH)-SO3Na
(1)上述反应类型为________反应。若使CH3 CH(OH)-SO3Na全部变成乙醛,可采用的试剂是__________或__________;分离乙醛的操作方法 _____________。
(Ⅱ)实验室利用苯甲醛(安息香醛)制备苯甲醇和苯甲酸的化学原理:
![]() (此原理适用于无α-氢的醛)
(此原理适用于无α-氢的醛)
已知部分物质的性质:
苯甲醇:熔点(℃):-15.3℃,稍溶于水,易溶于有机溶剂;
苯甲醛:熔点(℃):-26℃,微溶于水,易溶于有机溶剂;
苯甲酸:溶解度为0.344g(25℃),易溶于有机溶剂.主要过程如图所示:
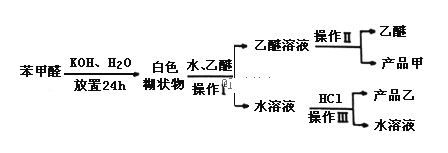
回答下列问题:
(2)操作Ⅰ的名称是___________,乙醚溶液中所溶解的主要成分是__________;
(3)操作Ⅲ的名称是________,产品乙是_______________.
(4)按上述操作所得的产品甲中常含有一定量的有机杂质___________(填写杂质的名称);限用下列试剂:酸性KMnO4、稀NaOH溶液、稀H2SO4、饱和NaHSO3溶液.写出检验产品甲中含有该杂质的过程:______________________________.
【答案】.加成NaOHHCl蒸馏萃取分液苯甲醇过滤苯甲酸苯甲醛取少量产品甲于试管中,向试管中滴加适量的饱和NaHSO3溶液,如果有晶体析出,说明含有苯甲醛
【解析】
Ⅰ、(1)R-CHO+NaHSO3![]() R-CH(OH)-SO3Na反应类型为加成反应,根据可逆反应R-CHO+NaHSO3R-CH(OH)-SO3Na,要想使R-CH(OH)-SO3Na全部变成乙醛即使平衡向逆反应方向移动,可以采取加入氢氧化钠或者盐酸消耗亚硫酸钠使平衡逆向移动;分离互溶的有机物采用蒸馏的方法;
R-CH(OH)-SO3Na反应类型为加成反应,根据可逆反应R-CHO+NaHSO3R-CH(OH)-SO3Na,要想使R-CH(OH)-SO3Na全部变成乙醛即使平衡向逆反应方向移动,可以采取加入氢氧化钠或者盐酸消耗亚硫酸钠使平衡逆向移动;分离互溶的有机物采用蒸馏的方法;
Ⅱ、由流程可知,苯甲醛与KOH反应生成苯甲醇、苯甲酸钾,然后加水、乙醚萃取苯甲醇,操作Ⅰ分层乙醚与水溶液,则为萃取分液,则乙醚溶液中含苯甲醇,操作II为蒸馏,得到产品甲为苯甲醇;水溶液中含苯甲酸钾,加盐酸发生强酸制取弱酸的反应,生成苯甲酸,苯甲酸的溶解度小,则操作Ⅲ为过滤,则产品乙为苯甲酸,以此来解答。
Ⅰ、(1)R-CHO+NaHSO3![]() R-CH(OH)-SO3Na反应类型为加成反应;因为可逆反应R﹣CHO+NaHSO3R﹣CH(OH)﹣SO3Na,要想使CH3CH(OH)﹣SO3Na全部变成乙醛即使平衡向逆反应方向移动,可以采取加入氢氧化钠或者盐酸消耗亚硫酸钠使平衡逆向移动,所以可以加入的为NaOH或者HCl;分离互溶的有机物采用蒸馏的方法,所以分离乙醛的操作方法为蒸馏,
R-CH(OH)-SO3Na反应类型为加成反应;因为可逆反应R﹣CHO+NaHSO3R﹣CH(OH)﹣SO3Na,要想使CH3CH(OH)﹣SO3Na全部变成乙醛即使平衡向逆反应方向移动,可以采取加入氢氧化钠或者盐酸消耗亚硫酸钠使平衡逆向移动,所以可以加入的为NaOH或者HCl;分离互溶的有机物采用蒸馏的方法,所以分离乙醛的操作方法为蒸馏,
故答案为:加成;NaOH或HCl;蒸馏;
Ⅱ、由流程可知,苯甲醛与KOH反应生成苯甲醇、苯甲酸钾,然后加水、乙醚萃取苯甲醇,操作Ⅰ分层乙醚与水溶液,则为萃取分液,则乙醚溶液中含苯甲醇,操作II为蒸馏,得到产品甲为苯甲醇;水溶液中含苯甲酸钾,加盐酸发生强酸制取弱酸的反应,生成苯甲酸,苯甲酸的溶解度小,则操作Ⅲ为过滤,则产品乙为苯甲酸;
(2)根据以上分析,操作Ⅰ分层乙醚与水溶液,则为萃取分液,故答案为:萃取分液;苯甲醇;
(3)根据以上分析,操作Ⅲ为过滤,产品乙是苯甲酸,故答案为:过滤;苯甲酸;
(4)根据苯甲醛与KOH反应生成苯甲醇、苯甲酸钾,所得混合物中可能还有未反应的苯甲醛,然后加水、乙醚萃取苯甲醇和未反应的苯甲醛,则乙醚溶液中含苯甲醇和未反应的苯甲醛,所以操作II为蒸馏,得到产品甲为苯甲醇和未反应的苯甲醛,根据醛类是重要的工业原料,可以跟亚硫酸氢钠饱和溶液发生加成反应,生成是α﹣羟基磺酸钠(易溶于水,不溶于饱和亚硫酸氢钠溶液),所以可以通过取少量产品甲于试管中,向试管中滴加适量的饱和NaHSO3溶液,如果有晶体析出,说明含有苯甲醛,
故答案为:苯甲醛;取少量产品甲于试管中,向试管中滴加适量的饱和NaHSO3溶液,如果有晶体析出,说明含有苯甲醛。


科目:高中化学 来源: 题型:
【题目】某溶液中可能存在Fe3+、Fe2+、I-、HCO![]() 、Cl-、NO
、Cl-、NO![]() 六种离子中的几种。进行下列实验:
六种离子中的几种。进行下列实验:
①取少量溶液滴加KSCN溶液,溶液呈红色;
②另取少量原溶液滴加盐酸,溶液的棕黄色加深。
据此可以推断,该溶液中一定大量存在的阴离子是( )
A. I- B. HCO![]() C. Cl- D. NO
C. Cl- D. NO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型。根据如图回答下列问题:
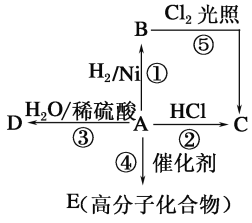
(1)写出A分子中的官能团名称:___________
(2)写出B、D的结构简式:B____________,D____________,
(3)写出②、⑤两步反应的化学方程式,并注明反应类型:
②_____________、反应类型________。
⑤______________、反应类型________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用铜萃取剂M,通过如下反应实现铜离子的富集:
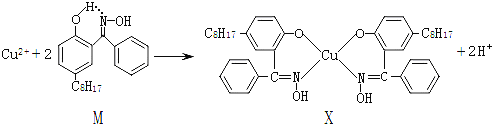
(1)关于M所含元素的说法正确的是______________。
A.电负性由大到小顺序:O>N>C>H
B.第一电离能由大到小的顺序:O>N>C
C.氮原子以sp2杂化轨道与氧原子形成σ键
D.从物质分类角度M属于芳香烃,M中所有的碳原子不可能共面
E.组成M元素的氢化物稳定性:CH4<H2O<NH3
(2)上述反应中断裂和生成的化学键有_______(填序号)。
A.氢键 B.配位键 C.金属键 D.范德华力 E.共价键 F.离子键
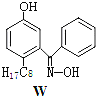
(3)M与W(分子结构如上图)相比,M的水溶性小,更利于Cu2+的萃取。M水溶性小的主要原因是_______________。
(4)基态Cu2+的外围电子排布图为________________,Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律。判断Sc3+、Zn2+的水合离子为无色的依据是_____________________________________________________________。
离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
(5)已知:Y原子最高价氧化物对应水化物的酸性最强。铜与Y形成化合物的晶胞如附图所示(黑点代表铜原子,空心圆代表Y原子)。
①该晶体的化学式为_______________。(用元素符号表示)
②已知铜和Y原子的电负性分别为1.9和3.0,则铜与Y原子形成的化合物属于____________(填“离子”或“共价”)化合物。
③已知该晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则该晶体中铜原子与Y原子之间的最短距离为_______________pm(只写计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列酸性H2CO3>HClO>HCO3—,下列有关叙述中正确的是
①向NaClO溶液中通入少量二氧化碳的离子反应方程式为:2ClO—+CO2+H2O=2HC1O+CO32—
②向KI和KBr混合溶液中,加入足量FeCl3溶液,用CCl4萃取后取上层中的液体少许并加入AgNO3溶液,有淡黄色沉淀生成
③向FeI2溶液中滴加少量氯水。反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl—
④卫生间的洁厕灵不能跟84消毒液混用,其离子方程式为:ClO—+Cl—+2H+=Cl2↑+H2O
A.②④ B.①③ C.②③ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①R—Br―→R—OH(R表示烃基);
②苯环上原有的取代基对新导入的取代基进入苯环的位置有显著的影响;
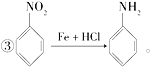
以下是用苯作为原料制备一系列化合物的转化关系图:
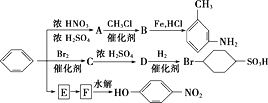
(1)写出A转化为B的化学方程式:______________________。
(2)图中苯转化为E,E转化为F省略了条件,请写出E、F的结构简式:
E________________,F_____________________。
(3)B分子中苯环上的任意两个氢被溴原子取代后,得到的二溴代物有____种同分异构体。
(4)上述转化中涉及到9个反应,其中不属于取代反应的共有_____个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列无色溶液中的离子能大量共存的是( )
A.H+、K+、OH-、Cl-B.Na+、Cu2+、SO42-、NO3-
C.Mg2+、Na+、SO42-、Cl-D.Ba2+、K+、CO32-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的分类或变化说法正确的是
A. Na2CO3、BaCl2是常见的强电解质,且溶于水时均会破坏水的电离平衡
B. NO2经降温加压凝成无色液体为物理变化,NO2排水收集到无色气体为化学变化
C. Na2OSiO2是一种简单的硅酸盐,露置于空气中会变质
D. 植物油可萃取溴水中的溴而使溴水褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com