
����Ŀ����������ʵ��������������õ��Ľ�����ȷ����
ѡ�� | ����������� | ʵ����� |
A | ��FeSO4�������գ�����������ͨ�������ữ��BaCl2��Һ�У�������ɫ���� | �����к���SO3(g) |
B | ��(NH4)2Fe(SO4)2��Һ�У�����������ˮ�����ٵ���KSCN��Һ����Һ��� | ԭ(NH4)2Fe(SO4)2���ֻ���ȫ������ |
C | ����֧��ʢ��2mLKI3��Һ���Թ��зֱ���������Һ�������ữ��AgNO3��Һ��ǰ����Һ����ɫ�������л�ɫ���� | ԭKI3��Һ�д���I3- |
D | ��3mL���м���1mLҺ�壬Ȼ���������FeBr3��ַ�Ӧ���ﵹ��ˮ�У��ձ��ײ��к�ɫ��״Һ�� | �屽�ʺ�ɫ��������ˮ���ܶȱ�ˮ�� |
A. A B. B C. C D. D
���𰸡�AC
��������A����FeSO4��������2FeSO4=Fe2O3��SO2��SO3������������ͨ�������ữ��BaCl2��Һ�У�������ɫ������BaSO4����A��ȷ��B��Ӧ�ȵ���KSCN��Һ�����ٵ���������ˮ����Һ��죬��B����C������֧��ʢ��2mLKI3��Һ���Թ��зֱ���������Һ�������ữ��AgNO3��Һ��ǰ����Һ����ɫ��˵����Һ����I2 �������л�ɫ������˵����Һ�д���I�D ����ԭKI3��Һ�д���I3-![]() I-+I2ƽ�⣬��C��ȷ��D����3mL���м���1mLҺ�壬Ȼ���������FeBr3��ַ�Ӧ���ﵹ��ˮ�У��ձ��ײ��к�ɫ��״Һ�壬������л��㣬����NaOH��Һ�����NaOH��Һ��Ӧ���ɿ����Ե����Σ����屽���������Ʋ���Ӧ�������ᴿ���ã��ᴿ���屽����ɫ����D����ѡAC��
I-+I2ƽ�⣬��C��ȷ��D����3mL���м���1mLҺ�壬Ȼ���������FeBr3��ַ�Ӧ���ﵹ��ˮ�У��ձ��ײ��к�ɫ��״Һ�壬������л��㣬����NaOH��Һ�����NaOH��Һ��Ӧ���ɿ����Ե����Σ����屽���������Ʋ���Ӧ�������ᴿ���ã��ᴿ���屽����ɫ����D����ѡAC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A.�ܶ��ʻ���ˮ������ζ��������
B.�ѻ����ѽ⡢��������ڻ�ѧ�仯
C.�������֬��һ�������¾���ˮ��
D.���Ͳ�˿����Ҫ�ɷ�����ά��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ�����ڱ��У�ͬ����Ԫ��ԭ�Ӿ�����ͬ��
A. ���Ӳ��� B. �˵����
C. ��������� D. ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ƣ�NaClO2����һ����Ҫ������������Ҫ����ˮ��ɰ�ǡ���֬��Ư����ɱ����������һ����ȡ�������ƵĹ������̣�

��֪����NaClO2���ܽ�������¶����߶������ʵ������¿ɽᾧ����NaClO23H2O��
��ClO2����ֻ�ܱ�����ϡ��״̬���Է�ֹ��ը�Էֽ⣬�����ֺϳ����á�
��ClO2���������Ժͼ�����Һ�в����ȶ����ڡ�
��1������Ĥ�������ö��Ե缫���һ��ʱ������NaClO3�������������ܷ�ӦʽΪ��____________________________________________�� �����������ʳ��ˮ�ɴ���ˮ���ƶ��ɣ�����ʱ��Ϊ��ȥMg2����Ca2����Ҫ������Լ��ֱ�Ϊ___________��___________��
��2����������������������___________��
��3���������ڷ�Ӧ�Ļ�ѧ����ʽΪ___________________________________���������ڵ��¶Ȳ��˹��ߵ�ԭ��Ϊ��_______________________________��
��4������Һ�еõ�NaClO23H2O�־����ʵ�����������____��__________�����ˡ�ϴ�ӡ����¸�����
��5�����������Ͽ�֪����pH��2.0ʱ��ClO2���ܱ�I����ȫ��ԭ��Cl�������ⶨ��Ʒ��NaClO2��MΪ90.5g/ mol���ĺ������ֽ������²�����
����� | ��ȡ��ƷWg����ƿ�У�������pH��2.0 |
����� | ����ƿ�м���������KI���壬������������ָʾ�� |
����� | ��c mol/L��Na2S2O3��Һ�ζ�������I����S4O62�� |
�ٲ�����з�����Ӧ�����ӷ���ʽ��_______________________________________��
���������ζ���������ȥ��VmL Na2S2O3��Һ������Ʒ��NaClO2����������Ϊ��__________������ĸ��ʾ�����û�������֪2Na2S2O3��I2=Na2S4O6��2NaI��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ��Ӧ���ʵ���Ҫԭ���ǣ� ��
A. �μӷ�Ӧ������� B. �������
C. �¶Ⱥ�ѹǿ D. ����Ӧ����������Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1������ȼ�տ���ͨ����������;����
;��I��C3H8��g�� + 5O2��g�� = 3CO2��g�� +4H2O��l�� ��H��-a kJ��mol-1
;��II��C3H8��g�� = C3H6��g��+ H2��g�� ��H��+b kJ��mol-1
2C3H6��g��+ 9O2��g�� = 6CO2��g�� +6H2O��l�� ��H��-c kJ��mol-1
2H2��g��+O2 ��g�� = 2H2O��l�� ��H��-d kJ��mol-1 ��abcd��Ϊ��ֵ��
��ش�����������
���жϵ����ı���ͨ������;���ų���������;��I�ų�������__________��������������������������С������;��II�ų���������
��b ��a��c��d����ѧ��ϵʽ��___________________ ��
��2���״���һ����Ҫ���Լ������Ź㷺����;����ҵ�Ͽ�����CO2�Ʊ��״�����CH4��CO2��Ӧ��H2��CO��������H2��CO�����Ƽ״�����֪:
�� 2CH3OH��l��+3O2��g��=2CO2��g��+4H2O��l�� ��H1=-1450.0kJ��mol��1
�� 2CO��g��+O2��g��=2CO2��g�� ��H2=-566.0kJ��mol��1
�� 2H2��g��+O2��g��=2H2O��l�� ��H3=-571.6kJ��mol��1
��H2��CO��Һ̬�״����Ȼ�ѧ����ʽΪ______________________________________��
��3����ͼ��ʾ��ijͬѧ���һ�����ѣ�CH3OCH3��ȼ�ϵ�ز�̽���ȼҵԭ���ʹ�ͭ�ľ���ԭ����������װ����XΪ�����ӽ���Ĥ��

����Ҫ��ش�������⣺
��д������ͨ����һ���ĵ缫��Ӧʽ______________________________��
�����з������ܷ�Ӧ�����ӷ���ʽΪ________________________________��
�۽�0.2mol AgNO3��0.4mol Cu��NO3��2 ��0.6mol KCl����ˮ�����100ml��Һ���ö��Ե缫���һ��ʱ���ijһ�缫��������0.3mol Cu����ʱ����һ�缫�ϲ����������������״����Ϊ______________ L����Ҫʹ�������Һ�ָ������ǰ��״̬����Ҫ������������Ϊ_____________g ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�ĵ���ƽ��������ͼ��ʾ��

��1������A���ʾ25��ʱˮ�ĵ���ƽ�������Ũ�ȣ����¶����ߵ�100��ʱ��ˮ�ĵ���ƽ��״̬�ƶ���B�㣬���ʱˮ�����ӻ���________�仯��_________��
��2����pH=8��Ba��OH��2��Һ��pH=5��ϡ�����ϣ�������100��ĺ��£���ʹ�����Һ��pH=7����Ba��OH��2������������Ϊ__________________��
����A��B��C��D����ǿ����ʣ�������ˮ�е���ʱ�ɲ�������������ÿ������ֻ��һ���������һ����ظ����������� Na����Ba2����NH4+ ������ CH3COO����Cl����OH����SO42-����֪����A��C��Һ��pH������7��A��B����Һ��ˮ�ĵ���̶���ͬ����C��Һ��D��Һ����ʱֻ���ɰ�ɫ������B��Һ��C��Һ����ʱֻ���ɴ̼�����ζ�����壬A��Һ��D��Һ���ʱ����������
��A��__________________��B�� __________________��
�������ӷ���ʽ��ʾA��Һ�ʼ��Ե�ԭ��__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ijЩ�л���ı���ģ�ͣ����б�ʾΪCH4���ǣ� ![]() ������ԭ��
������ԭ�� ![]() ����̼ԭ�ӣ��� ��
����̼ԭ�ӣ��� ��
A.![]()
B.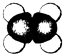
C.
D.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����Ƶ������У���ȷ����(����)
A. ������Ȼ���д�������̬
B. ����һ�ֻ�ɫ�Ĺ���
C. �ƿ��Ա�����ú�ͻ�CCl4��
D. ���Ż�ʱ������ɳ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com