
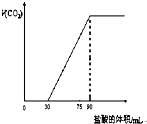
 取NaOH溶液50mL,通入一定量CO2,再向溶液中逐滴加入0.1mol/L盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列说法错误的是
取NaOH溶液50mL,通入一定量CO2,再向溶液中逐滴加入0.1mol/L盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列说法错误的是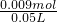 =0.18mol/L,故B正确;
=0.18mol/L,故B正确; =0.003mol,由碳原子守恒可知二氧化碳的物质的量为0.003mol×2=0.006mol,则加入足量盐酸产生CO2气体体积在标准状况下为0.006mol×22.4L/mol=1344mL,故C正确;
=0.003mol,由碳原子守恒可知二氧化碳的物质的量为0.003mol×2=0.006mol,则加入足量盐酸产生CO2气体体积在标准状况下为0.006mol×22.4L/mol=1344mL,故C正确;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:


|
温度 实验次数 |
起始温度t1/℃ |
终止温度 t2/℃ |
温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 4.0 |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸溶液50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸溶液50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:| 温度 实验次数 |
起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4℃ 3.4℃ |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
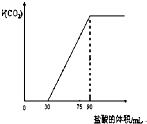 取NaOH溶液50mL,通入一定量CO2,再向溶液中逐滴加入0.1mol/L盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列说法错误的是( )
取NaOH溶液50mL,通入一定量CO2,再向溶液中逐滴加入0.1mol/L盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列说法错误的是( )| A、原NaOH溶液中通入CO2后,所得溶液中c(CO32-)小于c(HCO3-) | B、NaOH溶液中,Na+的物质的量浓度为0.18mol/L | C、NaOH溶液中通入CO2后,再加入足量盐酸产生CO2气体体积(标准状况)1344mL | D、0-30mL之间的离子方程式:CO32-+H+═HCO3- |
查看答案和解析>>
科目:高中化学 来源:2011届上海市奉贤区高三4月调研测试(二模)化学试卷 题型:单选题
取NaOH溶液50mL,通入一定量CO2,再向溶液中逐滴加入0.1mol/L盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列说法错误的是
| A.原NaOH溶液中通入CO2后,所得溶液中c(CO32-)小于C(HCO3-) |
| B.NaOH溶液中,Na+的物质的量浓度为0.18 mol/L |
| C.NaOH溶液中通入CO2后,再加入足量盐酸产生CO2气体体积(标准状况)1344mL。 |
| D.0—30mL之间的离子方程式:CO32-+H+→HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com