
| A. | 将pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸所需加入的pH变大 | |
| B. | 盐酸和醋酸都可用相应的钠盐与浓度硫酸反应制取 | |
| C. | 相同pH的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸的pH变大 | |
| D. | 相同pH的盐酸和醋酸分别跟锌反应时,产生氢气的起始速率相等 |
分析 A.CH3COOH是弱酸,加水稀释促进CH3COOH电离;
B.较强的酸能和弱酸盐反应生成弱酸;
C.向酸中加入相应的钠盐固体,如果是弱酸,则抑制弱酸电离;
D.反应速率与离子浓度成正比.
解答 解:A.CH3COOH是弱电解质,加水稀释,电离程度增大,将等体积pH=4的HCl和CH3COOH稀释到pH=5的溶液,CH3COOH所加的水量应该多,且不能说明HCl完全电离,所以不能证明盐酸是强酸,故A错误;
B.盐酸和醋酸都可用相应的钠盐与浓硫酸反应制取,说明硫酸酸性大于CH3COOH,浓硫酸制备HCl,是利用难挥发性酸制备易挥发性酸,不能证明盐酸是强酸,故B错误;
C.等体积、相同pH的盐酸和醋酸溶液中分别加入相应的钠盐固体,CH3COOHpH变大,说明醋酸钠抑制CH3COOH电离,则证明CH3COOH是弱酸;加入氯化钠固体后,溶液pH不变,说明HCl完全电离,氯离子不影响HCl电离,所以能证明盐酸是强酸,故C正确;
D.反应速率与离子浓度成正比,开始时氢离子浓度相等,所以反应速率相等,不能说明HCl完全电离、CH3COOH部分电离,所以不能说明盐酸是强酸、CH3COOH是弱酸,故D错误;
故选C.
点评 本题考查了电解质强弱判断,明确强弱电解质的区别“电离程度”即可解答,注意D中反应速率只与氢离子浓度有关,与电解质强弱无关,为易错点.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源:2016-2017学年天津市高二上9月调研化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.人们把能够发生有效碰撞的分子叫做活化分子,同时把活化分子具有的能量叫活化能
B.化学反应不一定都有能量变化
C.活化能接近于零的反应,当反应物相互接触时,反应瞬间完成,而且温度对其反应速率几乎没有什么影响
D.活化能的大小不仅意味着一般分子成为活化分子的难易,也会对化学反应前后的能量变化产生影响
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高一上第一次月考化学卷(解析版) 题型:选择题
下列有关气体摩尔体积的说法中正确的是
A.在标准状况下,1 mol任何物质的体积都约为22.4 L
B.在标准状况下 ,0.5 mol任何气体的体积都约为11.2 L
,0.5 mol任何气体的体积都约为11.2 L
C.在常温常压下,1 mol任何气体的体积都约为22.4 L
D.在标准状况下,0.5 mol CCl4所占有的体积约为11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
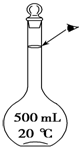 实验室配制500mL 0.5mol•L-1的NaCl溶液,有如下操作步骤:
实验室配制500mL 0.5mol•L-1的NaCl溶液,有如下操作步骤:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
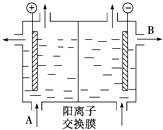 按要求完成下列各小题
按要求完成下列各小题查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com