
【题目】在一定温度下,把2体积N2和6体积H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通如图所示。容器中发生以下反应:N2+3H2![]() 2NH3(正反应为放热反应)。若反应达平衡后,测得混合气体的体积为7体积,据此回答下列问题:
2NH3(正反应为放热反应)。若反应达平衡后,测得混合气体的体积为7体积,据此回答下列问题:
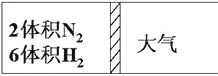
(1)保持上述反应温度不变,设a、b、c分别代表初始加入的N2、H2和NH3的体积,如果反应达到平衡后混合气体中各物质的体积仍与上述平衡时完全相同,那么:
①若a=1,c=2,则b=____。在此情况下,反应起始时将向______(填“正”或“逆”)反应方向进行。
②若需规定起始时反应向逆反应方向进行,则c的范围是______。
(2)在上述装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是______,原因是_____。
【答案】3 逆 1<c≤4 降温 6.5<7,上述平衡需向气体体积缩小方向移动,故可采取降温措施
【解析】
(1)①反应达到平衡后混合气体中各物质的体积仍与上述平衡时完全相同,则在恒温恒压下,利用极限法计算,即按照化学计量数转化到左边应满足氮气和氢气体积比为1:3,则有(1+a):(3+b)=1:3,又因为a=1,因此b=3,反应前混合气体为8体积,反应后混合气体为7体积,根据方程式可知为达到同一平衡状态,氨气的体积必须减小,即平衡向逆反应方向移动。
②要使反应向逆反应方向移动,根据以上分析可知平衡时氨气为1体积,氨气的体积必须大于1体积,最大值则为2体积氮气和6体积氢气完全反应时生成的氨气的体积,即应该是4体积,所以1<c≤4。
(2)平衡后混合气体为6.5体积<7体积,恒压条件下,应该是改变温度影响平衡移动。由于正反应是放热反应,且是气体体积减小的反应,所以只能是降低温度。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下,0.1 mol·L1 H2C2O4的pH=1.3)
实验 | 装置 | 试剂a | 现象 |
① |
| Ca(OH)2溶液(含酚酞) | 溶液褪色,产生白色沉淀 |
② | 少量NaHCO3溶液 | 产生气泡 | |
③ | 酸性KMnO4溶液 | 紫色溶液褪色 | |
④ | C2H5OH和浓硫酸 | 加热后产生有香味物质 |
由上述实验所得草酸性质所对应的方程式不正确的是
A. H2C2O4有酸性,Ca(OH)2+ H2C2O4![]() CaC2O4↓+2H2O
CaC2O4↓+2H2O
B. 酸性:H2C2O4> H2CO3,NaHCO3+ H2C2O4![]() NaHC2O4+CO2↑+H2O
NaHC2O4+CO2↑+H2O
C. H2C2O4具有还原性,2![]() +5
+5![]() +16H+
+16H+![]() 2Mn2++10CO2↑+ 8H2O
2Mn2++10CO2↑+ 8H2O
D. H2C2O4可发生酯化反应,HOOCCOOH+2C2H5OH![]() C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A.1molN2与3molH2反应生成的NH3分子数为2NA
B.14g乙烯(C2H4)和丙烯(C3H6)混合气体中的原子总数为3NA
C.1molFe溶于过量硝酸,电子转移数为2NA
D.标准状况下,2.24LCCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电池的简易装置图如下所示,a、b、y、x电极材料均为惰性电极,分别从A、B处通入乙醇和O2,用该装置进行实验,下列说法正确的是( )

A. a电极反应式为C2H5OH+12OH――12e-=2CO2↑+9H2O
B. AlCl3溶液中的总反应为2Cl-+2H2O=Cl2↑+H2↑+2OH-
C. 反应开始后,观察到x电极附近出现白色沉淀
D. 左侧电池每通入32gO2,右侧电解池共生成2mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电化学法制备LiOH的实验装置如图,采用惰性电极,a口导入LiCl溶液,b口导入LiOH溶液,下列叙述正确的是( )

A.通电后阳极区溶液pH增大
B.阴极区的电极反应式为4OH-–4e-=O2↑+2H2O
C.当电路中通过1mol电子的电量时,会有0.25mol的Cl2生成
D.通电后Li+通过交换膜向阴极区迁移,LiOH浓溶液从d口导出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个温度恒定、容积固定的密闭容器中,发生可逆反应
mA(s)+nB(g) ![]() pC(g)+qD(g),已知n=p+q,且该反应为放热反应,反应达到平衡的标志是( )
pC(g)+qD(g),已知n=p+q,且该反应为放热反应,反应达到平衡的标志是( )
①体系的压强不再改变 ②气体的密度不再改变
③各气体的浓度不再改变 ④各气体的质量分数不再改变
⑤反应速率v(C)∶v(D)=p∶q
⑥单位时间内nmol B断键反应,同时pmol C也断键反应
A. ②③④⑥ B. ①②③④ C. ①②③④⑥ D. ④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠熔融盐燃料电池拥有比锂电池高一倍的能量密度,在同等电池体积下,可让电动汽车行驶距离成倍提升。如图所示是某钠熔融盐燃料电池,其中生成物Y是一种氧化物。下列说法不正确的是
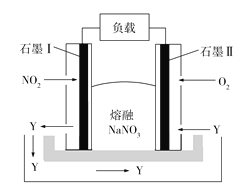
A. 电池工作时,石墨电极Ⅰ上电极反应式为2NO2 2e +O2![]() N2O5
N2O5
B. 电池工作时,![]() 向石墨电极Ⅰ移动
向石墨电极Ⅰ移动
C. 该电池充电时,石墨电极Ⅱ连接电源的负极
D. 电池工作时,外电路中流过1 mol电子,则消耗46 g NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下反应![]() 在一密闭容器中进行,测得平均反应速率v(C)=2v(B)。若该反应过程中气体的物质的量一直保持不变,则m、n、p、q可能依次是( )
在一密闭容器中进行,测得平均反应速率v(C)=2v(B)。若该反应过程中气体的物质的量一直保持不变,则m、n、p、q可能依次是( )
A.2、6、3、5B.3、1、2、2C.2、1、2、1D.1、3、2、2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定反应过程中产生氢气体积V,根据相关数据所绘制的图象如图所示,则曲线a、b、c、d所对应的实验组别可能依次是( )
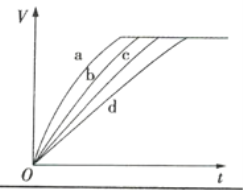
实验组别 | c(HCl)/(mol·L-1) | 温度/℃ | 形状(Fe) |
1 | 2.0 | 30 | 块状 |
2 | 2.5 | 30 | 块状 |
3 | 2.5 | 50 | 粉末状 |
4 | 2.5 | 30 | 粉末状 |
A.4、3、2、1B.1、2、3、4
C.3、4、2、1D.1、2、4、3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com