
����Ŀ��(15��)��Ҫ��ش������й����⡣
��1���ݱ�������ѧ�����з���һ�ֳ����´��ϳ�NH3�ķ�����2N2(g)+6H2O(l)=4NH3(g)+3O2(g)
��֪������Ϣ��
��������������ȿ��Ա�ʾ�������������ѧ�ϣ��涨��״�����ȶ����ʵ�������Ϊ0���������ʵ������ȣ�NH3(g)ΪmkJ��mol-1��H2O(l)ΪnkJ��mol-1��
��Ӧ����H=�����������֮��---��Ӧ���������֮��
�����ֻ�ѧ���ļ����������£�
![]()
������Ӧ�У���H=_______kJ��mol-1��H-N���ļ���Ϊ_______kJ��mol-1��
��2������������һ�������¿��Է������·�Ӧ��
SO2(g)+NO2(g)![]() SO3(g)+NO(g)����H= -42kJ��mol-1����1L�����ܱ������г���SO2(g)��NO2(g)������ʵ���������£�
SO3(g)+NO(g)����H= -42kJ��mol-1����1L�����ܱ������г���SO2(g)��NO2(g)������ʵ���������£�
ʵ���� | �¶� | ��ʼʱ���ʵ���/mol | ƽ��ʱ���ʵ���/mol | |
N(SO2) | N(NO2) | N(NO) | ||
�� | T1 | 0.80 | 0.20 | 0.18 |
�� | T2 | 0.20 | 0.80 | 0.16 |
�� | T3 | 0.20 | 0.30 | a |
��ʵ����У���2minʱ��÷ų���������4.2kJ����0~2minʱ���ڣ���SO2(g)��ʾ��ƽ����Ӧ����v(SO2)=_____________________��
��ʵ����У��ﵽƽ��ʱ��NO2��ת����Ϊ____________��
���ɱ������ݿ���֪��Tl______T2(���������������=��)��
��3���Է�ӦN2O4(g)![]() 2NO2(g) ��H��0 ���¶�ΪTl��T2ʱƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ������˵����ȷ����__________��
2NO2(g) ��H��0 ���¶�ΪTl��T2ʱƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ������˵����ȷ����__________��

a��A��C����ķ�Ӧ���ʣ�A��C
b��A��C�����������ɫ��A�Cdz
c����״̬A��״̬B�������ü��ȵķ���
d��A��C����Ļ�ѧƽ�ⳣ����A=C
��4����ҵ�ϣ�����ʯī��������Ϊ�缫������ȥ��ˮ�е�CN-(NΪ-3�ۣ���ͬ)

�����缫Ӧ����ֱ����Դ��____________(��д�缫����)��
��������Ӧ����ʽ��ƽ������Ӧ��д________��
�������Ϸ����ĵ缫��ӦΪ2Cl--2e-=Cl2����_______________��
���𰸡���1��4m-6n(1��) (2a+12b-3c-4m+6n)/12(2��)
��2����0.05 mol��L��1��min��1(2��) ��![]() ��100%(2��) ����(2��)
��100%(2��) ����(2��)
��3��d(2��)
��4�������� (1��) ��N2 (1��) ��CN- -2e- +2OH- = CNO- + H2O(2��)
��������
�����������1����H=�����������֮������Ӧ���������֮��=(4m+0)-(6n+0)=4m-6n����H-N���ļ���ΪxkJ��mol-1����H=��Ӧ��ļ��ܺ���������ļ��ܺ�=(2a+12b-12x-3c)=4m-6n�������x=(2a+12b-3c-4m+6n)/12��
��2����ʵ���������2minʱ��÷ų���������4.2kJ�������Ķ����������ʵ���Ϊ![]() =0.1mol����v(SO2)=
=0.1mol����v(SO2)=![]() =0.05mol/(L��min)��
=0.05mol/(L��min)��
��ʵ�������ƽ��ʱNOΪamol����μӷ�Ӧ�������������ʵ���Ϊamol���ʶ���������ת����Ϊ![]() ��100%=
��100%=![]() ��100%��
��100%��
����ʵ��ƽ��ʱ��NOΪ0.16mol������
SO2(g)+NO2(g)![]() SO3(g)+NO(g)
SO3(g)+NO(g)
��ʼ��(mol)��0.2 0.8 0 0
�仯��(mol)��0.16 0.16 0.16 0.16
ƽ����(mol)��0.04 0.64 0.16 0.16
T2�¶���ƽ�ⳣ��K=![]() =1��ͬ���ɼ����T2�¶���ƽ�ⳣ��K=
=1��ͬ���ɼ����T2�¶���ƽ�ⳣ��K=![]() =2.63���ɼ�����ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���ƽ�ⳣ����С����T1��T2��
=2.63���ɼ�����ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���ƽ�ⳣ����С����T1��T2��
��3��a����ͼ���֪��A��C���㶼�ڵ������ϣ�C��ѹǿ����A��C����ķ�Ӧ���ʣ�A��C����a����b����ͼ���֪��A��C���㶼�ڵ������ϣ�C��ѹǿ����A���C��ƽ�����淴Ӧ���У����淴Ӧ���������ڼ�С�������ѹǿ��ƽ���ƶ��Ľ������NO2Ũ���������ƣ�������ƽ���Ա�ԭƽ��Ũ�ȴ�ƽ��ʱNO2Ũ�ȱ�A��Ũ�ȸߣ�NO2Ϊ����ɫ���壬��A��C�����������ɫ��Adz��C���b����c�������¶ȣ���ѧƽ�������ƶ���NO2���������������ͼ���֪��A��NO2�������������T1��T2����״̬A��״̬B�������������ķ�������c������D����ͼ���֪��A��C���㶼�ڵ������ϣ���ѧƽ�ⲻ�䣬��d��ȷ����Ϊd��
��4�������ݷ����ĵ缫��Ӧ������֪�����������������ӵ�Դ�ĸ�����
����������ԭ��Ӧ��ԭ�����䷴Ӧ����ʽΪ3Cl2+2CNO-+8OH-�TN2+6Cl-+2CO32-+4H2O���ʴ�ΪN2��
����������������Ӧ�������ĵ缫��ӦʽΪ��CN--2e-+2OH-�TCNO-+H2O��2Cl--2e-�TCl2����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���A�ɷ�������ת�������������ʾ�Ϊ�л����������������ȥ��:

��֪�� ��R��R���ɱ�ʾ�������������
��R��R���ɱ�ʾ�������������
��ش�
��1��F�����ܶ�����ͬ������H2�ܶȵ�31�����ҷ�����������֪1 mol F�����������ò���H2 22.4 L����״��������F�ķ���ʽ��__________________��
��2��G��F����Է�������֮��Ϊ4����G��������________������ĸ����
a������������Һ��Ӧ b���������ᷢ��������Ӧ
c���������������ӳɷ�Ӧ d��1 mol G����2 mol����Cu��OH��2������Ӧ
��3��D����NaHCO3��Ӧ����������D���Է�Ӧ�õ�������Ԫ����������E��ʹ������Ȼ�̼��Һ��ɫ����D��E�Ļ�ѧ����ʽ��_______________________
��4��B��ͬ���칹��϶࣬д��һ�ֲ������ܷ���������Ӧ��ͬ���칹��ṹ��ʽ��_________��
��5��Aת��ΪB��F�Ļ�ѧ����ʽ��_________________________��
��6��ij������H��̼ԭ����С��10���˴Ź�������ֻ��һ��壬 ����ͬ������Ҳ�ɷ�������B �� C�ķ�Ӧ��ֻ����һ���л���I��I�Ľṹ��ʽ�� _______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���þ����з�̪��Һ���Ȼ�����Һ����ֽ�ֱ������ס�������װ�á�����������ȷ������ ��

A����ֽ�ϵ������Ӷ���̼��Ǩ��
B��a��d�����ĵ缫��Ӧʽ��ͬ
C��b��d������������Һ�����
D��c��d�������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й��������������ʾ��������(PM2.5��)Ϊ����������Ӱ�������������������Ⱦ�����Ҫ��ԴΪȼú��������β���ȡ���ˣ���PM2.5��SO2��NOx�Ƚ����о�������Ҫ���塣��ش��������⣺
�����ı�ú�����÷�ʽ�ɼ��ٻ�����Ⱦ��ͨ���ɽ�ˮ����ͨ�����ȵ�̼�õ�ˮú����
��1��ú���������в������к�����H2S����������Na2CO3��Һ���գ��÷�Ӧ�����ӷ���ʽΪ
(��֪��H2S��Ka1=1.3��10��7��Ka2=7.1��10��15��H2CO3��Ka1=4.4��10��7��Ka2=4.7��10��11)
��2���ֽ���ͬ����CO(g)��H2O(g)�ֱ�ͨ�˵����Ϊ2L�ĺ����ܱ������з������·�Ӧ��CO(g)��H2O(g)![]() CO2(g)��H2(g) ��H���õ���������
CO2(g)��H2(g) ��H���õ���������
ʵ���� | �¶��� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ�� ����ʱ��/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
�÷�Ӧ��![]() H 0(���������)������7500Cʱ������һ��ʵ�飬��2L�ĺ����ܱ������м���lmol CO��3mo1 H2O��2mo1 CO2��5mol H2�����ʱ�� ��(���������������������)��
H 0(���������)������7500Cʱ������һ��ʵ�飬��2L�ĺ����ܱ������м���lmol CO��3mo1 H2O��2mo1 CO2��5mol H2�����ʱ�� ��(���������������������)��
��3��һ�������£�ij�ܱ��������ѽ���A(g)��B(g) ![]() C(g)��D(g)/span> ��H��0�Ļ�ѧƽ�⣬��ʱ������ͼ����ͼ������ѡ���ж���t1ʱ�̲�ȡ�Ŀ��ܲ�������ƽ���ƶ�����ж���ȷ����
C(g)��D(g)/span> ��H��0�Ļ�ѧƽ�⣬��ʱ������ͼ����ͼ������ѡ���ж���t1ʱ�̲�ȡ�Ŀ��ܲ�������ƽ���ƶ�����ж���ȷ����

A����Сѹǿ��ͬʱ�����¶ȣ�ƽ�������ƶ�
B������A(g)Ũ�ȣ�ͬʱ�����¶ȣ�ƽ�ⲻ�ƶ�
C�����������¶�ѹǿ����ͨ��ϡ�����壬ƽ�ⲻ�ƶ�
����ѹ����Ȼ��(CNG)�������ŵ�֮һ�����ô�������NOxת�������CO2��N2��
��CH4(g)��4NO(g)![]() 2N2(g)��CO2(g)��2H2O(g) ��H1��0
2N2(g)��CO2(g)��2H2O(g) ��H1��0
��CH4(g) ��2NO2(g)![]() N2(g) ��CO2(g) ��2H2O(g) ��H2��0
N2(g) ��CO2(g) ��2H2O(g) ��H2��0
��4���ռ�ij����β��������NOx�ĺ���Ϊ1.12%(�������)�����ü��齫����ȫת��Ϊ�����壬����1��104L(��״����)��β����Ҫ����30g����β����V (NO)�UV (NO2)= ��
��5���ڲ�ͬ�����£�NO�ķֽ���ﲻͬ���ڸ�ѹ�£�NO(��X)��40���·ֽ��������ֻ�����(��Y��Z)����ϵ�и�������ʵ�����ʱ��仯������ͼ��ʾ��д��Y��Z�Ļ�ѧʽ��

��6�� ij�о���ѧϰС�飬Ϊ�о��⻯ѧ�����������ɣ���һ����ʵ�����У������������Ҫ�ɷ�ΪRH(��)��NO��NO2��O3��PAN(CH3COOONO2)���������ʵ����Ũ����ʱ�����ʧ����¼����ͼ������ͼ�����ݣ��������ۣ����������

A��NO����ʧ�����ʱ�RH��
B��NO����NO2
C��RH��NO2��������PAN��O3
D��O3����PAN
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��п�̸ɵ����һ��һ�ε�أ����Ϊ����п���м���̼��������Χ��̼�ۣ��������̣��Ȼ�п���Ȼ�淋���ɵ������õ���ڷŵ���̲���MnOOH��������ˮ�������մ����÷ϵ�ؿ��Եõ����ֻ���ԭ�ϣ��й�������ͼ��ʾ��
�ܽ��/(g/100gˮ)
�¶�/�� ������ | 0 | 20 | 40 | 60 | 80 | 100 |
NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
������ | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp����ֵ | 10-17 | 10-17 | 10-39 |
�ش��������⣺
����ͨп�̵�طŵ�ʱ��������Ҫ��ӦΪ��Zn+2NH4Cl+2MnO2��Zn(NH3)2Cl2+2MnOOH���õ���У�����������Ҫ��________��������������Ҫ��Ӧʽ�� ��
�Ӽ������ҺpH��ʹ��Һ������������Ũ�ȴﵽ mol/L�����պ���ȫ����������Ũ��С��1��10-5mol/Lʱ��������Ϊ�����ӳ�����ȫ���������Ӽ����pHΪ ��п��ʼ�������ٶ�Zn2��Ũ��Ϊ0.1mol/L����
��2���ڷ�����ѧ�г���Na2C2O4��������Һ��ɫ����Ϊ�����ʲⶨKMnO4��Һ��Ũ�ȡ���H2SO4��Һ�У���Ӧ���£�2MnO��5C2O��16H��![]() 2Mn2������Һ��ɫ����10CO2����8H2O��
2Mn2������Һ��ɫ����10CO2����8H2O��
������W g Na2C2O4���100 mL����Һ����ȡ20.00 mL������ƿ�У�������KMnO4��ҺӦװ��__________(���ʽ����ʽ��)�ζ����С����εζ� ѡ��ָʾ����������Ҫ����������Ҫ�������жϵζ����յ��������____ ___��
�����ζ�����ʼ�������յ������ͼ��ʾ��������KMnO4�����ʵ���Ũ��Ϊ_ (�����ʽ)��
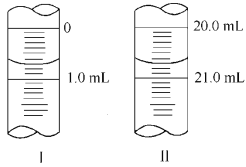
�����ζ���������������ⶨ��KMnO4��Һ��Ũ��___(�ƫ�ߡ�����ƫ�͡����䡱)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���㶹������;�㷺�����ϣ��ϳ��㶹�ص�·�������������Լ������P��Ӧ������ʡ������

��1����ķ���ʽΪ_____________��
��2����Ӧ���ķ�Ӧ������_____________����Ӧ�ܵķ�Ӧ������_____________��
��3��д����Ӧ���Ļ�ѧ��Ӧ����ʽ____________ _________��
��4���㶹���ڹ���NaOH��Һ����ȫˮ��Ļ�ѧ����ʽΪ_____________________��
��5�����Ǣ���ͬ���칹�壬���ķ����к��б�������̼̼˫���������Ϻ���������λȡ�������ܷ���������Ӧ�����Ľṹ��ʽΪ_______________����д��������
��6��һ�������£�![]() ��CH3CHO�ܷ������Ʒ�Ӧ�١��ڵ�������Ӧ���������ɵ��л���Ľṹ��ʽΪ ��
��CH3CHO�ܷ������Ʒ�Ӧ�١��ڵ�������Ӧ���������ɵ��л���Ľṹ��ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������CO2��������̼������ɱ�ĺ�ѹ�ܱ������з�Ӧ��C(s)+CO2(g)![]() 2CO(g)��ƽ��ʱ����ϵ����������������¶ȵĹ�ϵ����ͼ��ʾ��
2CO(g)��ƽ��ʱ����ϵ����������������¶ȵĹ�ϵ����ͼ��ʾ��

��֪�������ѹP������=������ѹP����)���������������˵����ȷ����( )
A��550��ʱ��������������壬v��������v����������С��ƽ�ⲻ�ƶ�
B��650��ʱ����Ӧ��ƽ���CO2��ת����Ϊ25.0%
C��T��ʱ��������������CO2��CO��ƽ�����淴Ӧ�����ƶ�
D��925��ʱ����ƽ���ѹ����ƽ��Ũ�ȱ�ʾ�Ļ�ѧƽ�ⳣ��KP=24.0P������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��һ�����ص�ʾ��ͼ����Ĥ�����ĵ���ʷֱ�ΪNa2S2��NaBr3���ŵ���ΪNa2S4��NaBr����֪�ŵ�ʱNa+ ���ҳ���׳��ƶ�������Ը�װ�ù���������������ȷ����

A���ŵ���̣��׳ط���������Ӧ
B���ŵ���̣���ط�Ӧ��2S22��+ Br3��= S42��+ 3Br��
C�������̣��ҳ�Ϊ������
D�������̣�������������������2mol��������·�е���ת��2mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ����������װ��̽�������백��֮��ķ�Ӧ������A��F�ֱ�Ϊ�����������ķ���װ�ã�CΪ��������������백����Ӧ��װ�á�

��ش��������⣺
��1��װ��F�з�����Ӧ�����ӷ���ʽΪ_______________________________��
��2��װ��A����ƿ�п�װ�Լ�_______________________________________________��
��3��Bװ�õ�������_______________________��Eװ�õ�����______________________________��
��4��ͨ��Cװ�õ�����������߽ϳ����ұ߽϶̣�Ŀ����_________________________��
��5��װ��C�ڳ���Ũ��İ��̲��������ڱ����ᣬ��һ�������ǿ�������Ҫ�ɷ�֮һ��д����Ӧ�Ļ�ѧ����ʽ�� _���÷�Ӧ���������ͻ�ԭ�������ʵ���֮��Ϊ_____________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com