
| A. | 被氧化的元素是氯元素 | |
| B. | 氧化产物与还原产物的物质的量之比为l:1 | |
| C. | 消耗l mol还原剂,转移5 mol电子 | |
| D. | 净化1 L含CN-1.04 mg•L-1的废水,理论上需用2×l0-5mol C1O2 |
分析 二氧化氯(ClO2)能净化有毒废水中的氰化钠(NaCN),生成NaCl、CO2和N2,反应中Cl元素的化合价由+4降低为-1价,被还原,生成还原产物,N元素的化合价由-3价升高为0,C元素的化合价由+2价升高为+4价,被氧化,生成氧化产物,则根据得失电子守恒,反应的离子方程式为:2CN-+2ClO2=2CO2↑+N2↑+2Cl-,以此解答.
解答 解:A.C、N元素化合价都升高,被氧化,故A错误;
B.根据以上分析,反应的离子方程式为:2CN-+2ClO2=2CO2↑+N2↑+2Cl-,C、N元素化合价都升高,则氧化产物有N2、CO2,Cl元素的化合价由+4降低为-1价,则还原产物为Cl-,所以氧化产物与还原产物的物质的量之比为3:2,故B错误;
C.由反应可知,消耗l mol还原剂即l molCN-,转移4-2+3=5 mol电子,故C正确;
D.根据以上分析,反应的离子方程式为:2CN-+2ClO2=2CO2↑+N2↑+2Cl-,所以净化1 L含CN-1.04 mg•L-1的废水,理论上需用$\frac{1.04×10{\;}^{-3}g/L×1L}{26g/mol}$=4.0×10-5mol C1O2,故D错误.
故选C.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化及氧化还原反应中规律性知识为解答的关键,选项D为解答的易错点,题目难度不大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸和碱反应生成1mol水时所放出的热 | |
| B. | 1mol酸和1mol碱反应生成盐和水时所放出的热 | |
| C. | 强酸稀溶液和强碱稀溶液反应生成1mol液态水时所放出的热 | |
| D. | 稀Ba(OH)2和稀H2SO4完全反应生成1mol水时所放出的热 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
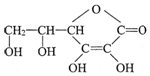 ,分子式为C6H8O6;其中的-OH叫羟基(填官能团名称).在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是蓝色褪去,说明维生素C有还原性(填氧化性或还原性).
,分子式为C6H8O6;其中的-OH叫羟基(填官能团名称).在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是蓝色褪去,说明维生素C有还原性(填氧化性或还原性).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 防止废旧电池重金属盐对土壤水资源造成污染,大力开发废旧电池综合利用技术 | |
| B. | 为减少北方雾霾,作物秸秆禁止直接野外燃烧,研究开发通过化学反应转化为乙醇用作汽车燃料 | |
| C. | 为节约垃圾处理的费用,大量采用垃圾的填埋 | |
| D. | 为减少温室气体排放,应减少燃煤.大力发展新能源,如核能、风能、太阳能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
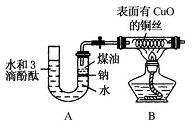 某课外活动小组为了检验钠与水反应的产物,设计如图装置(夹持装置省略).首先在U形管内加入少量煤油和儿粒钠块,再从U形管高端加入水(含有酚酞),赶出空气,一会儿点燃酒精灯加热铜丝.
某课外活动小组为了检验钠与水反应的产物,设计如图装置(夹持装置省略).首先在U形管内加入少量煤油和儿粒钠块,再从U形管高端加入水(含有酚酞),赶出空气,一会儿点燃酒精灯加热铜丝.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
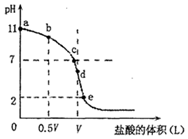 c(NH4+)+c(H+)=c(NH3•H2O)+c(OH-)
c(NH4+)+c(H+)=c(NH3•H2O)+c(OH-)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
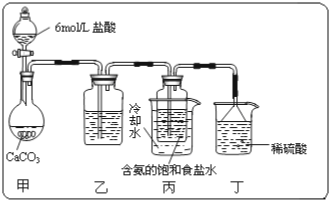
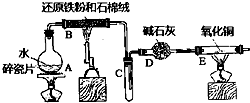 某校化学小组学生利用如图所列装置进行“铁与水反应”的实验,并进行了其他有关实验.(图中夹持及尾气处理装置均已略去)
某校化学小组学生利用如图所列装置进行“铁与水反应”的实验,并进行了其他有关实验.(图中夹持及尾气处理装置均已略去)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com