
【题目】某校化学兴趣小组用如图所示过程除去硫酸铝中含有的Mg2+、K+杂质离子并尽可能减少硫酸铝的损失。
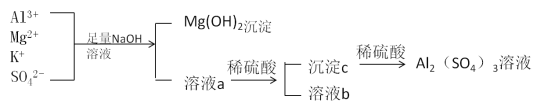
请回答下列问题:
(1)混合物中加入足量氢氧化钠溶液时,反应的离子方程式是________________、________________________________。
(2)能否用氨水代替氢氧化钠溶液____________,其原因是____________________________。
(3)溶液a中存在的离子有________________________,在溶液a中加入稀硫酸时需控制硫酸的量,其原因是__________________________________________,改进方法是__________________________________________________________。
【答案】Mg2++2OH-===Mg(OH)2↓ Al3++4OH-==AlO2-+2H2O(或Al3++3OH-==Al(OH)3↓、Al(OH)3+OH-=== AlO2-+2H2O) 不能 因为在Al3+与氨水反应生成Al(OH)3后,Al(OH)3不能与氨水继续反应,从而不能将Al(OH)3与Mg(OH)2分开 SO42-、K+、AlO2-、OH-、Na+ 因为Al(OH)3能与强酸反应,所以在加入稀硫酸时,需要控制硫酸的量 向溶液a中通入过量的二氧化碳气体。
【解析】
原硫酸铝溶液中加入足量的NaOH溶液时发生的反应有Al2(SO4)3+8NaOH=2NaAlO2+4H2O+3Na2SO4,MgSO4+2NaOH=Mg(OH)2↓+Na2SO4,所以溶液a中主要成分是NaAlO2、K2SO4、Na2SO4、NaOH。向溶液a中加稀硫酸时先是中和反应,再有Al(OH)3沉淀生成2NaAlO2+H2SO4+2H2O=2Al(OH)3↓+Na2SO4,但要控制加入的稀硫酸的用量,因为Al(OH)3能溶解于硫酸。沉淀c是Al(OH)3,再与稀硫酸反应生成Al2(SO4)3。由此分析。
(1)原硫酸铝溶液中加入足量氢氧化钠溶液时发生反应的化学方程式为:Al2(SO4)3+8NaOH=2NaAlO2+4H2O+3Na2SO4,MgSO4+2NaOH=Mg(OH)2↓+Na2SO4,再根据离子方程式书写原则,将化学方程式改写成离子方程式为:Al3++4OH-=AlO2-+2H2O [ 或Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O ],Mg2++2OH-=Mg(OH)2↓。
(2)Al3++3NH3·H2O=Al(OH)3↓+3NH4+,Al(OH)3不能溶解于氨水。不能用氨水代替氢氧化钠溶液,是因为在Al3+与氨水反应生成Al(OH)3后,Al(OH)3不能与氨水继续反应,从而不能将Al(OH)3与Mg(OH)2分开。
(3)原Al2(SO4)3溶液中加入足量的NaOH溶液时发生的反应有:Al2(SO4)3+8NaOH=2NaAlO2+4H2O+3Na2SO4,MgSO4+2NaOH=Mg(OH)2↓+Na2SO4,因此溶液a中主要成分是NaAlO2、Na2SO4、K2SO4、NaOH,所以溶液a中存在的离子有AlO2-、SO42-、K+、OH-、Na+。Al(OH)3+3H+=Al3++3H2O,因为Al(OH)3能与强酸反应,所以在加入稀硫酸时,需要控制硫酸的量。因为Al(OH)3不会溶解于H2CO3等弱酸,可利用H2CO3制取Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,能防止部分Al(OH)3转化成Al3+,所以改进的方法是向溶液a中通入过量的二氧化碳气体。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知:常温下,Ksp(AgNO2)=2×10-8 mol2·L-2;Ksp(AgCl)=1.8×10-10 mol2·L-2。
(1)向2 mL 0.1 mol·L-1 NaNO2 溶液中滴加几滴稀硝酸银溶液,出现白色沉淀,再滴入0.5 mol·L-1 NaCl溶液,发生反应:AgNO2(s)+Cl-(aq)![]() AgCl(s)+NO2-(aq),则该反应的化学平衡常数K= 。
AgCl(s)+NO2-(aq),则该反应的化学平衡常数K= 。
(2)取物质的量浓度均为 0.1 mol·L-1 NaNO2、NaCl的混合溶液,逐滴加入AgNO3溶液(忽略体积改变)。当 AgNO2开始沉淀时,计算溶液中Cl-的物质的量浓度(写出必要的计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R为前四周期原子序数依次增大的元素。X原子有3个能级,且每个能级上的电子数相等;Z原子的不成对电子数在同周期中最多,且Z的气态氢化物在同主族元素的氢化物中沸点最低;X、Y、R三元素在周期表中同族。
(1)R元素基态原子的价层电子排布式为_____________________________。
(2)下图表示X、Y、Z的四级电离能变化趋势,其中表示Y的曲线是_________(填标号)。
[Failed to download image : http://192.168.0.10:8086/QBM/2018/6/1/1957930255540224/1961602752167936/STEM/676db9e64b15468faa67ccb9aa300976.png]
(3)化合物(XH2=X=O)分子中X原子杂化轨道类型分别是_____________,1mol (X2H5O)3Z=O分子中含有的σ键与π键的数目比为_______________。
(4)Z与氯气反应可生成一种各原子均满足8电子稳定结构的化合物,其分子的空间构型为________________。
(5)某R的氧化物立方晶胞结构如图所示,该物质的化学式为____________。(用元素符号表示),已知该晶体密度为ρg/cm3,距离最近的原子间距离为dpm,则R的相对原子质量为____________。(阿伏加德罗常数为NA)
[Failed to download image : http://192.168.0.10:8086/QBM/2018/6/1/1957930255540224/1961602752167936/STEM/02395761f35f4972ad3c8807ad342892.png]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)按要求回答下列问题:
(1)在一定的温度和压强下,2 体积 X Y 2 (g)跟 3 体积Z2(g)化合生成 2 体积气态化合物,则该气态化合物的化学式是 _________(用X、Y、Z表示)
(2)用KMnO4氧化盐酸,其反应方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,该反应中,氧化剂是________。当有1mol KMnO4和一定量盐酸恰好完全反应,反应后溶液的体积为2L ,则所得溶液中Cl—的物质的量浓度为_______,被氧化的HCl的物质的量为________。
(II)现有下列物质:①H2O、②空气、③Mg、④CaCO3、⑤H3PO4、⑥CuSO4﹒5H2O、⑦浓硝酸、⑧无水酒精、⑨硫酸、⑩盐酸。
其中,属于电解质的是____________(填序号,下同);属于非电解质的是____________;属于强电解质的是____________;能导电的是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92.4kJ/mol起始反应物为N2和H2物质的量之比为1:3,且总物质的量不变,在不同压强和濫度下,反应达到平衡时体系中NH3的物质的量分数如下表:
2NH3(g)ΔH=-92.4kJ/mol起始反应物为N2和H2物质的量之比为1:3,且总物质的量不变,在不同压强和濫度下,反应达到平衡时体系中NH3的物质的量分数如下表:
温度 物质的量分数 压强 | 400℃ | 450℃ | 500℃ | 600℃ |
20MPa | 0.387 | 0.274 | 0.189 | 0.088 |
30MPa | 0.478 | 0.359 | 0.260 | 0.129 |
下列说法正确的是
A. 体系中NH3的物质的量分数越大,则正反应速率越大
B. 反应达到平衡时,N2和H2的转化率之比均为1
C. 反应达到平衡时,放出的热量均为92.4kJ
D. 600℃,30MPa下反应达到平衡时,生成NH3的物质的量最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL1 molL-1HCl溶液中滴加1 molL-1CH3COONa溶液,所得混合液的pH 与加入CH3COONa溶液的体积(V)的变化如图所示。下列说祛错误的是
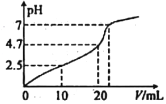
A. 常温下,CH3COOH 的电离常数Ka≈2.0×10-5
B. 随着V的增加,混合液中水的电离程度在不断增加
C. 当V=20 mL时,混合液中c(Na+)>c(Cl-)>c(CH3COO-)>c(H+)>c(OH-)
D. 当混合液的pH=7时,混合液中c(Cl-)=c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于氧化还原反应的是
A. Zn+2HCl===ZnCl2+H2↑
B. Ca(ClO)2+2HCl===CaCl2+2HClO
C. Pb3O4+8HCl(浓)===3PbCl2+Cl2↑+4H2O
D. 3Cl2+6KOH(浓)![]() 5KCl+KClO3+3H2O
5KCl+KClO3+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ag2SO4微溶于水,可溶于硝酸。溶液X中可能含有Na+、Ca2+、Fe2+、Cl-、Br-、CO![]() 、SiO
、SiO![]() 、SO
、SO![]() 中的几种离子。为了确定其组成,某同学进行了如下实验:
中的几种离子。为了确定其组成,某同学进行了如下实验:

下列说法正确的是( )
A. 溶液X中一定含有Na+、Cl-和SiO![]()
B. 溶液X中一定不含Ca2+、Br-
C. 为确定溶液X中是否含有SO![]() ,可取溶液2,加入BaCl2溶液
,可取溶液2,加入BaCl2溶液
D. 在溶液X中依次滴入盐酸、双氧水和硫氰化钾溶液后,溶液将变成血红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若在加入铝粉能放出H2的溶液中,分别加入下列各组离子,肯定不能共存的
A. Fe3+、Mg2+、Cl-、Na+
B. Ba2+、Mg2+、![]() 、Ca2+
、Ca2+
C. ![]() 、Na+、K+、
、Na+、K+、![]()
D. ![]() 、K+、Al3+、H+
、K+、Al3+、H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com