
| A. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO42-═BaS04↓+2H2O | |
| B. | 酸性介质中KMnO4氧化 H2O2:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| C. | 等物质的量的MgCl2、Ba(OH)2 和 HCl 溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| D. | 铅酸蓄电池充电时的正极反应:PbSO4+2H2O-2e-═PbO2+4H++SO42- |
分析 A.反应生成硫酸钡和水;
B.发生氧化还原反应,遵循电子、电荷守恒;
C.先发生酸碱中和反应;
D.充电时的正极上硫酸铅失去失去被氧化.
解答 解:A.Ba(OH)2溶液中滴加稀硫酸的离子反应为Ba2++2OH-+2H++SO42-═BaS04↓+2H2O,故A正确;
B.酸性介质中KMnO4氧化 H2O2的离子反应为2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O,遵循电子、电荷守恒,故B正确;
C.等物质的量的MgCl2、Ba(OH)2 和 HCl 溶液混合的离子反应为2H++Mg2++4OH-═Mg(OH)2↓+2H2O,故C错误;
C.铅酸蓄电池充电时的正极反应为PbSO4+2H2O-2e-═PbO2+4H++SO42-,故D正确;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应、电解的电极反应的离子反应考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
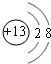 E在周期表中的位置第三周期第VIIA族
E在周期表中的位置第三周期第VIIA族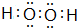
| 选项 | a | b | c | d |
| X | 温度 | 加入氢气 | 加入丙 | 温度 |
| Y | n(丙) | 丙的转化率 | n(生成物) | n(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78g过氧化钠晶体中,含2NA个阴离子 | |
| B. | 1L 0.1 mol/L醋酸溶液中含有的氢离子数为0.1NA | |
| C. | 在O2参与的反应中,1 mol O2作氧化剂时得到的电子数一定是4NA | |
| D. | 常温下16g O2与O3的混合气体中含氧原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铁片与氯化铜溶液反应:Fe+Cu2+═Cu+Fe3+ | |
| B. | 氯化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| C. | 碳酸钠溶液与盐酸反应:Na2CO3+2H+═2Na++CO2↑+H2O | |
| D. | NaHCO3溶液中加入过量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | A | ||
| Y | C | B |
| A. | 元素原子半径大小顺序为:A<B<C<Y | |
| B. | 最高价含氧酸的酸性强弱顺序为:H2YO3<H2XO3 | |
| C. | A、B两种元素气态氢化物的沸点高低顺序为:HA<HB | |
| D. | B、C简单离子的还原性强弱顺序为:B-<C2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过煤的直接或间接液化可以获得各种芳香烃 | |
| B. | 通过石油的催化重整等工艺可获取芳香烃 | |
| C. | 石油的裂化的目的主要是为了提高轻质油的产量 | |
| D. | 石油通过常压分馏可以得到石油气、汽油、煤油、柴油等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com