
| A、在一定条件下,Na2CO3溶液存在水解平衡:CO32-+H2O?HCO3-+OH-,通入CO2,平衡朝正反应方向移动 | B、25℃时,浓度均为0.2mol/L的NaHCO3和Na2CO3溶液中,只存在电离平衡,不存在水解平衡 | C、热的纯碱液去油污效果好,因为加热可使CO32-的水解程度增大,溶液碱性增强,去污力降低 | D、pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) |


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
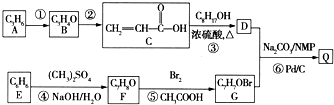
| pd/C | Na2CO3/NMP |






查看答案和解析>>
科目:高中化学 来源: 题型:




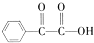


 )氧化生成,写出该反应的化学方程式:
)氧化生成,写出该反应的化学方程式:

 )经浓硫酸催化而生成,写出该反应的化学方程式:
)经浓硫酸催化而生成,写出该反应的化学方程式:



查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
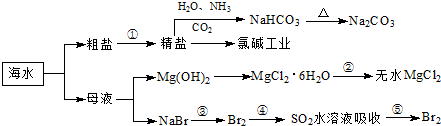
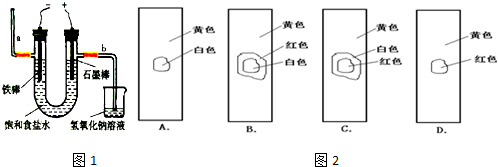
| ||
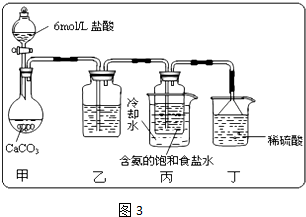
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关碳酸钠或碳酸氢钠能发生水解的观点正确的是
A.在一定条件下,Na2CO3溶液存在水解平衡:CO![]() +H2O
+H2O![]() HCO
HCO![]() +OH-,通入CO2,平衡朝正反应方向移动
+OH-,通入CO2,平衡朝正反应方向移动
B.25℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,只存在电离平衡,不存在水解平衡
C.热的纯碱液去油污效果好,因为加热可使CO![]() 的水解程度增大,溶液碱性增强,去污力降低
的水解程度增大,溶液碱性增强,去污力降低
D.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com