
【题目】苯乙烯(![]() )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
![]() (g)
(g)![]()
![]() (g)+H2(g) △H
(g)+H2(g) △H
(1)已知:
化学键 | C-H | C-C | C=C | H-H |
键能/kJ/mol | 412 | 348 | 612 | 436 |
计算上述反应的△H=________ kJ·mol-1。
(2)500℃时,在恒容密闭容器中,充入a mol乙苯,反应达到平衡后容器内气体的压强为P;若再充入bmol的乙苯,重新达到平衡后容器内气体的压强为2P,则a_______b(填“>” “<”或“=”),乙苯的转化率将________(填“增大” “减小”或“不变”)。
(3)工业上,通常在乙苯(EB)蒸气中掺混N2(原料气中乙苯和N2的物质的量之比为1︰10,N2不参与反应),控制反应温度600℃,并保持体系总压为0.1Mpa不变的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
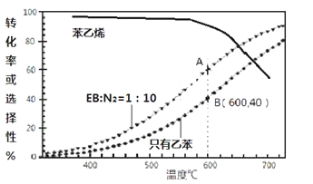
①A,B两点对应的正反应速率较大的是________。
②掺入N2能提高乙苯的平衡转化率,解释说明该事实___________________________。
③用平衡分压代替平衡浓度计算600℃时的平衡常数Kp=________。(保留两位有效数字,分压=总压×物质的量分数)
④控制反应温度为600℃的理由是___________________________。
【答案】+124 < 减小 B 正反应方向气体分子数增加,加入氮气稀释,相当于起减压的效果 0.019MPa 600℃时,乙苯的转化率和苯乙烯的选择性均较高。温度过低,反应速率慢,转化率低;温度过高,选择性下降。高温还可能使催化剂失活,且能耗大
【解析】
(1)焓变=反应物总键能-生成物总键能,由有机物的结构可知,应是-CH2CH3中总键能与-CH=CH2、H2总键能之差,故△H=(5×412+348-3×412-612-436)kJmol-1=+124kJmol-1;
(2)该反应为气体增多的反应;假设a=b,且在充入b mol乙苯时将容器体积扩大为原来的2倍,则此时达到等效平衡,压强依然为P,实际情况时容器体积不变,则需将容器体积压缩至和原平衡相同,假设此过程中平衡不移动,则压缩后压强为2P,但实际情况是压缩体积时平衡会逆向移动,压强减小,即平衡后压强小于2P,若想要压强达到2P,则需要充入更多的乙苯,所以a<b;恒容充入乙苯,体系压强增大,平衡会在等效平衡的基础上左移,导致乙苯的转化率减小;
(3)①A点和B点温度相同,容器恒压,则充入氮气后容器体积变大,气体浓度减小,浓度越小反应速率越小,所以B点正反应速率较大;
②保持总压不变,充入N2,容器体积增大,各组分的浓度同倍数减小,相当于减小压强,利于反应正向进行,乙苯转化率增大;
③600℃时乙苯的转化率为40%,不妨设设初始投料为1mol乙苯,则转化乙苯0.4mol,剩余0.6mol,根据方程式![]() (g)
(g)![]()
![]() (g)+H2(g)可知,生成苯乙烯0.4mol,氢气0.4mol,压强之比等于气体物质的量之比,总压强为0.1MPa,则p(乙苯)=
(g)+H2(g)可知,生成苯乙烯0.4mol,氢气0.4mol,压强之比等于气体物质的量之比,总压强为0.1MPa,则p(乙苯)=![]() ,p(苯乙烯)=p(H2)=
,p(苯乙烯)=p(H2)=![]() ,则平衡常数Kp=
,则平衡常数Kp=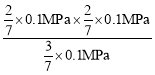 =0.019MPa;
=0.019MPa;
④由于600℃时,乙苯的转化率和苯乙烯的选择性均较高。温度过低,反应速率慢,转化率低;温度过高,选择性下降,过高温度还可能使催化剂失活,且能耗大,所以控制反应温度为600℃。


科目:高中化学 来源: 题型:
【题目】将图中所列仪器组装为一套实验室蒸馏工业酒精的装置,并进行蒸馏。
(三) | (一) | (五) | (二) | (六) | (四) |
|
|
|
|
|
|
(1)图中Ⅰ、Ⅱ、Ⅲ三种仪器的名称是__、__、__。
(2)将以上仪器按(一)→(六)顺序,用字母a,b,c…表示连接顺序。
e接(_______),(_______)接(_______),(_______)接(_______),(_______)接(_______)。
(3)Ⅰ仪器中c口是__,d口是__。(填“进水口”或“出水口”)
(4)蒸馏时,温度计水银球应放在__位置。
(5)在Ⅱ中注入工业酒精后,加几片碎瓷片的目的是__。
(6)给Ⅱ加热,收集到沸点最低的馏分是__。收集到78℃左右的馏分是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在CO2中,Mg燃烧生成MgO和C。下列说法正确的是( )
A. 元素C的单质只存在金刚石和石墨两种同素异形体
B. Mg、MgO中镁元素微粒的半径:r(Mg2+)>r(Mg)
C. 在该反应条件下,Mg的还原性强于C的还原性
D. 该反应中化学能全部转化为热能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
CH2=CH2+Br2 → BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140 ℃脱水生成乙醚
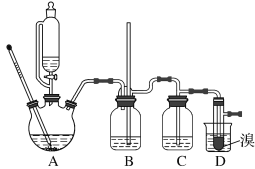
用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/(g·cm-3) | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132. | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170 ℃左右,其最主要目的是________(填正确选项前的字母)。
a .引发反应 b. 加快反应速度 c. 防止乙醇挥发 d. 减少副产物乙醚生成
(2)在装置C中应加入________(填正确选项前的字母),其目的是吸收反应中可能生成的酸性气体。
a .水 b .浓硫酸 c .氢氧化钠溶液 d .饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是_______________________。
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在________层(填“上”或“下”)。
(5)若产物中有少量未反应的Br2,最好用________(填正确选项前的字母)洗涤除去。
a 水 b 氢氧化钠溶液 c 碘化钠溶液 d 乙醇
(6)若产物中有少量副产物乙醚,可用________的方法除去。
(7)反应过程中应用冷水冷却装置D,其主要目的是_______________________;但又不能过度冷却(如用冰水),其原因是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种微生物燃料电池的结构示意图如下所示,关于该电池的叙述正确的是( )
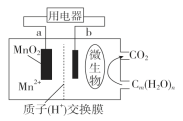
A. 电池工作时,电子由a流向b
B. 微生物所在电极区放电时发生还原反应
C. 放电过程中,H+从正极区移向负极区
D. 正极反应式为:MnO2+4H++2e-===Mn2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是药物合成中的一种重要中间体,下面是H的一种合成路线:
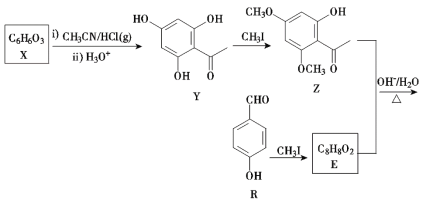
回答下列问题:
(1)X的结构简式为_______,其中所含官能团的名称为______;Y生成Z的反应类型为_______。
(2)R的化学名称是________。
(3)由Z和E合成F的化学方程式为__________________。
(4)同时满足苯环上有4个取代基,且既能发生银镜反应,又能发生水解反应的Y的同分异构体有________种,其中核磁共振氢谱上有4组峰,峰面积之比为1∶2∶2∶3的同分异构体的结构简式为________(一种即可)。
(5)参照上述合成路线,以乙醛和![]() 为原料(其他试剂任选),设计制备肉桂醛(
为原料(其他试剂任选),设计制备肉桂醛(![]() )的合成路线_______________。
)的合成路线_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用有关概念判断下列叙述正确的是( )
A.1mol H2燃烧放出的热量为H2的燃烧热
B.Na2SO3和H2O2的反应为氧化还原反应
C.![]() 和
和![]() 互为同系物
互为同系物
D.BaSO4的水溶液不导电,故BaSO4是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大。W的气态氢化物遇湿润的红色石蕊试纸变蓝色,X是地壳中含量最高的元素,Y在同周期主族元素中原子半径最大,Z与Y形成的化合物的化学式为YZ。下列说法不正确的是
A.W在元素周期表中的位置是第二周期VA族
B.用电子式表示的形成过程为:![]()
C.同主族中Z的气态氢化物稳定性最强
D.X与Y形成的两种常见的化合物中,阳离子和阴离子的个数比均为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将反应Cu(s) + 2Ag+(aq)![]() Cu2+(aq) + 2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是 ( )
Cu2+(aq) + 2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是 ( )
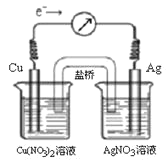
A. KNO3盐桥中的K+移向Cu(NO3)2溶液
B. 当电流计指针为0时,该反应达平衡,平衡常数K=0
C. 若此时向AgNO3溶液中加入NaCl固体,随着NaCl量的增加,电流计指针向右偏转幅度减小→指针指向0→向左偏转
D. 若此时向Cu(NO3)2溶液中加入NaOH固体,随着NaOH量的增加电流计指针向右偏转幅度减小→指针指向0→向左偏转
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com