
【题目】将图中所列仪器组装为一套实验室蒸馏工业酒精的装置,并进行蒸馏。
(三) | (一) | (五) | (二) | (六) | (四) |
|
|
|
|
|
|
(1)图中Ⅰ、Ⅱ、Ⅲ三种仪器的名称是__、__、__。
(2)将以上仪器按(一)→(六)顺序,用字母a,b,c…表示连接顺序。
e接(_______),(_______)接(_______),(_______)接(_______),(_______)接(_______)。
(3)Ⅰ仪器中c口是__,d口是__。(填“进水口”或“出水口”)
(4)蒸馏时,温度计水银球应放在__位置。
(5)在Ⅱ中注入工业酒精后,加几片碎瓷片的目的是__。
(6)给Ⅱ加热,收集到沸点最低的馏分是__。收集到78℃左右的馏分是__。
【答案】冷凝管 蒸馏烧瓶 锥形瓶 i h a b f g w 进水口 出水口 h(或蒸馏烧瓶支管口处) 防止暴沸 甲醇 乙醇
【解析】
(1)根据常见仪器的结构分析判断;
(2)按组装仪器顺序从左到右,从下到上,结合蒸馏装置中用到的仪器排序;
(3)冷凝水应该下进上出;
(4)温度计测量的是蒸汽的温度;
(5)加碎瓷片可以防止暴沸;
(6)工业酒精中含有少量甲醇,据此分析判断。
(1)根据图示,图中Ⅰ、Ⅱ、Ⅲ三种仪器的名称分别为冷凝管、蒸馏烧瓶、锥形瓶,故答案为:冷凝管;蒸馏烧瓶;锥形瓶;
(2)按蒸馏装置组装仪器顺序从左到右,从下到上,正确的顺序为:e→i→h→a→b→f→g→w,故答案为:i;h;a;b;f;g;w;
(3)冷凝水应是下进上出,延长热量交换时间,达到较好的冷凝效果,因此Ⅰ仪器中c口是进水口,d口是出水口;故答案为:进水口;出水口;
(4)蒸馏装置中温度计测量的是蒸汽的温度,温度计水银球应放在蒸馏烧瓶支管口处(或h),故答案为:蒸馏烧瓶的支管口(或h);
(5)为防止烧瓶内液体受热不均匀而局部突然沸腾(爆沸)冲出烧瓶,需要在烧瓶内加入几块沸石,故答案为:防止暴沸;
(6)工业酒精中含有少量甲醇,水的沸点为100℃,酒精的沸点在78℃左右,甲醇的沸点低于78℃,给Ⅱ加热,收集到沸点最低的馏分是甲醇,收集到78℃左右的馏分是乙醇;
故答案为:甲醇;乙醇。


 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:
【题目】最早的麻醉药是从南美洲生长的古柯植物提取的可卡因,目前人们已实验并合成了数百种局部麻醉剂,多为羧酸酯类。F是一种局部麻醉剂,其合成路线:
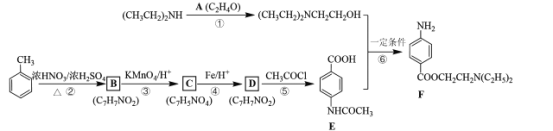
回答下列问题:
(1)已知A的核磁共振氢谱只有一个吸收峰,写出A的结构简式____。
(2)B的化学名称为________。
(3)D中的官能团名称为____,④和⑤的反应类型分别为________、____。
(4)写出⑥的化学方程式____。
(5)C的同分异构体有多种,其中-NO2直接连在苯环上且能发生银镜反应的有_____种,写出其中苯环上一氯代物有两种的同分异构体的结构简式____________。
(6)参照上述流程,设计以对硝基苯酚钠、乙醇和乙酰氯(CH3COCl)为原料合成解热镇痛药非那西丁(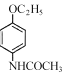 )的合成路线(无机试剂任选)。已知:
)的合成路线(无机试剂任选)。已知: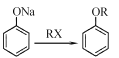 __________
__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温、同压等质量的SO2和CO2气体,下列有关比较的叙述中,正确的是( )
A.分子个数比为16:11B.密度比为1:1
C.体积比为16:11D.原子个数比为11:16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列说法正确的是
A. 标准状况下,2.24L苯含C-H键的数H为0.6NA
B. 5.6gFe与过量稀硝酸反应,转移的电子数为0.3NA
C. K35ClO3与浓H37Cl反应制得7.1g氯气,则生成的Cl2分子数为0.1NA
D. 6.4gCu与40 mL10mol/L浓硝酸充分反应,生成的NO2分子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题。
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)元素②的原子结构示意图为_____。
(2)元素③、④、⑤、⑥原子半径由大到小为_____。
(3)上述8种元素中,非金属性最强的是_____。
(4)元素②、③形成的气态氢化物稳定性:_____>_____;元素①、③、⑤可形成既含离子键又含极性共价键的化合物,写出其电子式:_____。
(5)元素⑦的最高价氧化物对应的水化物与元素⑤最高价氧化物对应的水化物溶液反应的离子方程式为_____。
(6)从原子结构的角度解释元素③和⑦的非金属性强弱:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,科学家通过对稻壳进行控制性焚烧热解,从中提取一种叫做生物质纳米结构二氧化硅的超高活性材料,将少量这种材料掺入混凝土中,即可轻易制备出超高强度和超高耐久性能的高性能混凝土。关于二氧化硅下列说法中正确的是( )
A.二氧化硅溶于水显酸性,所以二氧化硅属于酸性氧化物
B.二氧化碳通入硅酸钠溶液中可以得到硅酸
C.由CaCO3+SiO2![]() CaSiO3+CO2↑可知硅酸的酸性比碳酸强
CaSiO3+CO2↑可知硅酸的酸性比碳酸强
D.二氧化硅是酸性氧化物,它不溶于任何酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质发生变化时,所克服的粒子间相互作用属同种类型的是( )
A.亚硫酸氢钠和硫酸氢钠分别溶解在水中
B.硝酸铵与硝酸分别受热变为气体
C.氯化钠与氯化氢分别溶解在水中
D.碘与干冰分别受热变为气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮及其化合物在化工生产和国防工业中具有广泛应用。请回答:
(1)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。该工艺可采用铬的氧化物为催化剂,其反应机理如图:
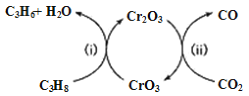
①图中催化剂为__________________。
②该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是______________。
(2)现向三个体积均为2L的恒容密闭容器I、Ⅱ、Ⅲ中,均分别充入1molCO和2molH2发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为T1、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。
CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为T1、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。
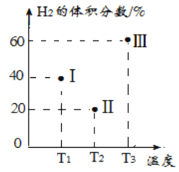
①5min 时三个容器中的反应达到化学平衡状态的是容器__________(填序号)。
②0-5min内容器I中用CH3OH表示的化学反应速率v(CH3OH)=_________。(保留两位有效数字)。
③当三个容器中的反应均达到平衡状态时,平衡常数最小的是容器_________。(填序号)
(3)在密闭容器中充入10molCO和8 molNO,发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)△H=-762kJ·mo-1,如图为平衡时NO的体积分数与温度、压强的关系。
N2(g)+2CO2(g)△H=-762kJ·mo-1,如图为平衡时NO的体积分数与温度、压强的关系。
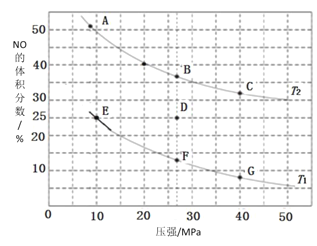
①由上图判断,温度T1_____T2(填“低于”或“高于”)。
②压强为20MPa、温度为T2下,若反应进行到10 min达到平衡状态,在该温度下,如图所示A、B、C对应的pA(CO2)、pB(CO2)、pC(CO2)从大到小的顺序为_________。
③若在D点对反应容器降温的同时缩小体积至体系压强增大,重新达到的平衡状态可能是图中A~G点中的__________点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯(![]() )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
![]() (g)
(g)![]()
![]() (g)+H2(g) △H
(g)+H2(g) △H
(1)已知:
化学键 | C-H | C-C | C=C | H-H |
键能/kJ/mol | 412 | 348 | 612 | 436 |
计算上述反应的△H=________ kJ·mol-1。
(2)500℃时,在恒容密闭容器中,充入a mol乙苯,反应达到平衡后容器内气体的压强为P;若再充入bmol的乙苯,重新达到平衡后容器内气体的压强为2P,则a_______b(填“>” “<”或“=”),乙苯的转化率将________(填“增大” “减小”或“不变”)。
(3)工业上,通常在乙苯(EB)蒸气中掺混N2(原料气中乙苯和N2的物质的量之比为1︰10,N2不参与反应),控制反应温度600℃,并保持体系总压为0.1Mpa不变的条件下进行反应。在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图如下:
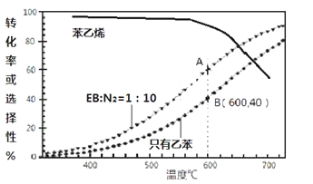
①A,B两点对应的正反应速率较大的是________。
②掺入N2能提高乙苯的平衡转化率,解释说明该事实___________________________。
③用平衡分压代替平衡浓度计算600℃时的平衡常数Kp=________。(保留两位有效数字,分压=总压×物质的量分数)
④控制反应温度为600℃的理由是___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com