
【题目】25℃时,将浓度均为0.1 mol·L-1、体积分别为Va和Vb的HX溶液与NH3·H2O溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液的pH的关系如图所示。下列说法不正确的是
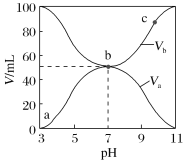
A. Ka(HX)的值与Kb(NH3·H2O)的值相等
B. b点,c(NH4+)+c(HX)=0.05 mol·L-1
C. a→c点过程中,  值不变
值不变
D. a、b、c三点,c点时水电离出的c(H+)最大
【答案】D
【解析】
A.b点加入等体积等浓度的HX和氨水,两者恰好完全反应生成NH4X,b点溶液的pH=7,说明X-与NH4+的水解程度相等,则Ka(HX)的值与Kb(NH3·H2O)的值相等,故A正确;
B.由图可知0.1 mol·L-1的HX溶液的pH=3,HX为弱酸,因为b点的pH=7,所以b点c(X-)=c(NH4+),,根据物料守恒c(X-)+c(HX)=0.1mol/L×0.05L/0.1L=0.05mol/L,则c(NH4+)+c(HX)=0.05 mol·L-1,故B正确;
C. a→ c点过程中,![]() ,水解平衡常数只与温度有关,温度不变,则
,水解平衡常数只与温度有关,温度不变,则![]() 值不变,故C正确;
值不变,故C正确;
D. b点加入等体积等浓度的HX和氨水,两者恰好完全反应生成NH4X,NH4X是弱酸弱碱盐,促进水电离,则a、b、c三点,b 点时水电离出的c(H+)最大,故D错误。答案选D。


科目:高中化学 来源: 题型:
【题目】FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性。
I.实验室制备FeBr2实验室用如图所示装置制取溴化亚铁。其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管,e是两个耐高温的瓷皿,其中盛有细铁粉。
实验开始时,先将铁粉加热至600—700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始。不断将d中液溴滴入温度为100—120℃的D中。经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁。

(1)若在A中盛固体CaCO3,a中盛6 mol/L盐酸。为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置和其中的试剂应是:B为_____________。C为________________。为防止污染空气,实验时应在F处连接盛___________的尾气吸收装置。
(2)反应过程中要不断通入CO2,其主要作用是____________________。
Ⅱ.探究FeBr2的还原性
(3)实验需要200 mL 0.1 mol/L FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外,还需要的玻璃仪器是_____________,需称量FeBr2的质量为:_________。
(4)取10 mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br一被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+
设计实验证明假设2是正确的:________
(5)请用一个离子方程式来证明还原性Fe2+>Br一________:
(6)若在40 mL上述FeBr2溶液中通入3×10-3mol Cl2,则反应的离子方程式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验安全问题的叙述中正确的是( )
A.少量的浓硫酸沾到皮肤上时,先用大量的水冲洗,再涂上硼酸溶液
B.取用化学药品时,应特别注意观察药品包装容器上的安全警示标志
C.凡是给玻璃仪器加热,都要加垫石棉网,以防仪器炸裂
D.各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镍是一种重要的化工中间体,是镍行业研究的热点。一种以石油化工中废镍催化剂(主要成分为NiCO3和SiO2,含少量Fe2O3、Cr2O3)为原料制备硫酸镍的工业流程如下:
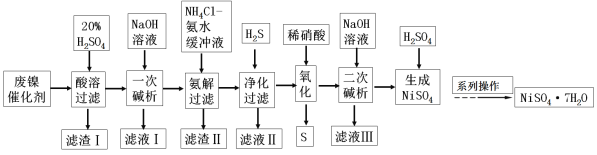
已知:① NiS、Ni(OH)2、Cr(OH)3均难溶于水,Cr(OH)3是两性氢氧化物。
②Fe(OH)3不溶于NH4Cl—氨水的混合液,Ni(OH)2溶于NH4Cl—氨水的混合液生成[Ni(NH3)6]2+。
③离子浓度≤10-5mol·L-1时,离子沉淀完全。
请回答下列问题:
(1)“酸溶”时应先将废镍催化剂粉碎,再与20%硫酸在100℃下反应2小时,该操作的目的为_____。
(2)“滤渣I”主要成分在工业上的用途为___(只写1种即可),NH4Cl的电子式为_____。
(3)“一次碱析”时,加入的NaOH溶液需过量,则含铬微粒发生反应的离子方程式为____。
(4)“氨解”的目的为________, “净化”时加入的H2S的目的是将镍元素转化为NiS沉淀,对应的离子方程式为:________。
(5)“氧化”时发生反应的离子方程为________。
(6)“二次碱浸”时,若使溶液中的Ni2+沉淀完全,则需维持c(OH-)不低于____。(已知Ni(OH)2的Ksp=2×10-15,![]() ≈1.4)。
≈1.4)。
(7)工业上利用电解法处理含氯化镍的酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是________。
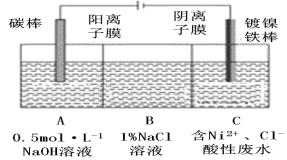
已知:①Ni2+在弱酸性溶液中发生水解;
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)。
A.碳棒上发生的电极反应:4OH--4e-=O2↑+2H2O
B.电解过程中,B中NaCl溶液的物质的量浓度将不断减小
C.为了提高Ni的产率,电解过程中需要控制废水pH
D.若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】nL三种气态烃混合物与足量氧气混合点燃后,恢复到原来状态(常温常压),体积共缩小2nL,这三种烃不可能的组合是 ( )
A. CH4、C2H4、C3H4以任意比混合
B. C2H6、C4H6、C2H2以2:1:2的物质的量之比混合
C. C3H8、C4H8、C2H2以11:14:26的质量之比混合
D. CH4、C3H6、C2H2以a:b:b体积比混合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 1mol乙酸在浓H2SO4存在下与足量乙醇反应可得1mol乙酸乙酯
B. 苯酚和甲醛通过加聚反应可制得酚醛树脂
C. 分子式为C5Hl0O2的物质与碳酸氢钠反应产生气体,符合条件的同分异构体有4种
D.  分子所有原子有可能共平面
分子所有原子有可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2A为二元弱酸。室温时,配制一组c(H2A)+c(HA-) +c(A2-)=0. 100mol·L-1的H2A和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如下图所示。下列指定溶液中微粒的物质的量浓度关系不正确的是

A. pH=2 的溶液中:c(H2A)+c(A2-)>c(HA- )
B. E点溶液中:c(Na+)-c(HA-)< 0. 100 mol L-1
C. c(Na+)= 0.100 mol·L-1的溶液中:c(H+) + c(H2A)=c(OH-)+c(A2-)
D. pH=7的溶液中:c(Na+)>2c(A2- )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氯化铝的熔点为190℃(2.02×105Pa),但它在180℃即开始升华。
(1)氯化铝是________________(填“离子化合物”或“共价化合物”)。
(2)在500K和1.01×105Pa时,它的蒸气密度(换算成标准状况时)为11.92g·L-1,且已知它的结构中有配位键,氯化铝的化学式为________,结构式为________。
(3)无水氯化铝在空气中强烈地“发烟”,其原因是______________________。
(4)设计一个更可靠的实验,判别氯化铝是离子化合物还是共价化合物。你设计的实验是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com