
【题目】汽车尾气中含有CO、NO等有害气体。
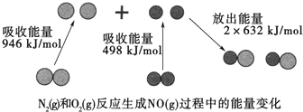
(1)汽车尾气中NO生成过程的能量变化如图示。1molN2和1molO2完全反应生成NO会________(填“吸收”或“放出”)________kJ能量。
(2)一种新型催化剂用于NO和CO的反应:2NO+2CO![]() 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在表中。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在表中。
实验编号 | t(℃) | NO初始浓度 (mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.2×10-3 | 5.80×10-3 | 82 |
Ⅱ | 280 | 1.2×10-3 | b | 124 |
Ⅲ | 350 | a | 5.80×10-3 | 82 |
①请将表中数据补充完整:a___________。
②能验证温度对化学反应速率规律的是实验____________________(填实验序号)。
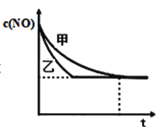
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线________________(填“甲”或“乙”)。
④在容积固定的容器中发生反应2NO+2CO![]() 2CO2+N2,不能说明已达到平衡状态的是________(不定项选择);
2CO2+N2,不能说明已达到平衡状态的是________(不定项选择);
A.容器内CO浓度不变 B.容器内NO的浓度等于CO2的浓度
C.v逆(NO)=2v正(N2) D.容器内混合气体密度保持不变
【答案】吸收 180 1.2×10-3 Ⅰ和Ⅲ 乙 BD
【解析】
由图中能量的变化,根据反应热=反应物断键吸收的能量-生成物成键释放出的能量的计算结果进行解答,利用控制变量的实验方法,验证温度、催化剂的比表面积对化学反应速率的影响,其他条件相同时,催化剂可以加快反应的速率,可逆反应达到平衡的标志就是变量不变了。
(1)由图知反应为N2(g)+O2(g)=2NO(g),反应热=反应物断键吸收的能量-生成物成键释放出的能量,该反应的反应热=(946+498)kJ/mol-2632kJ/mol=+180kJ/mol,所以这是一个吸热反应,1molN2和1molO2完全反应生成NO会吸收180kJ的能量,答案为:吸收;180;
(2)①要验证温度对化学反应速率的影响,温度要不同,其他条件要相同,观察表中三个实验中的数据可知a=1.210-3,答案为:1.210-3;
②验证温度对化学反应的影响,只有实验I、III的温度不同,其他条件相同,故答案为:Ⅰ和Ⅲ;
③催化剂比表面积越大,反应速率越快,到达平衡的时间越短,实验II中催化剂的比表面积大,反应速率快,由图可知,曲线乙的斜率大,反应快,答案为:乙;
④在容积固定的容器中发生反应2NO+2CO ![]() 2CO2+N2:
2CO2+N2:
A.没有达到平衡之前,CO的浓度一直在减小,容器内CO浓度不变则说明反应达到平衡,A不符题意;
B.反应过程中NO的浓度在不断减少,CO2的浓度不断增加,二者浓度相等,与是否达到平衡无关,B符合题意;
C.v逆(NO)=2v正(N2),速率之比等于化学计量数之比,说明正逆反应速率相等,反应达到平衡状态,C不符题意;
D.由质量守恒定律可知,反应前后气体质量不变,容器的体积不变,则容器内混合气体的密度一直保持不变,故混合气体的密度不变不能说明反应已达到平衡状态,D符合题意,答案为BD。


科目:高中化学 来源: 题型:
【题目】下列叙述正确的是()
A. NaCl的摩尔质量是58.5gB. 64g氧气中含有2mol氧
C. 4g氦气中含有2mol氦原子D. 0.1molCO2中含有6.02×1022个CO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有19.2克铜与400毫升稀硝酸发生如下反应3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(1)用双线桥表示出电子转移的方向和数目_____________
(2)计算稀硝酸的物质的量浓度_____________
(3)计算产生的气体在标况下的体积_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)单质M的晶体类型为________,其中M原子的配位数为________。
(2)元素Y基态原子的核外电子排布式为________,其同周期元素中,第一电离能最大的是________(写元素符号)。
(3)M与Y形成的一种化合物的立方晶胞如图所示。

①该化合物的化学式为________,已知晶胞参数a=0.542 nm,此晶体的密度为__________g·cm-3。(写出计算式,不要求计算结果。阿伏加德罗常数为NA)
②此化合物的氨水溶液遇到空气被氧化为深蓝色,其中阳离子的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉电池是应用广泛的二次电池,其总反应为:
Cd+2NiOOH+2H2O![]() 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2
制造密封式镍镉电池的部分工艺如下:
I.Ni(OH)2的制备
以硫酸镍(NiSO4)为原料制备Ni(OH)2的主要过程如下图所示。制备过程中,降低Ni(OH)2沉淀速率,可以避免沉淀团聚,提升电池性能。

已知:Ni2++6NH3H2O[Ni(NH3)6]2++6H2O
(1)操作a是 ____。
(2)制备过程中,需先加氨水,再加过量NaOH,请
①先加氨水的目的是 ___。
②用化学平衡移动原理分析加入NaOH需过量的原因是____。
(3)用无水乙醇代替水洗涤滤渣的优点是_____答出1条即可)。
II.镍镉电池的组装
主要步骤:①将Ni(OH)2和Cd(OH)2固定,中间以隔膜隔开(如下图所示);②将多组上述结构串联;③向电池中注入KOH溶液;④密封。
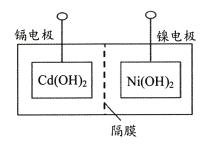
(4)下列对镍镉电池组装和使用的分析正确的是____(填字母序号)。
a.密封镍镉电池可以避免KOH变质
b.镍电极为电池的负极,镉电极为电池的正极
c.电池组装后,应先充电,再使用
III.过度充电的保护
电池充电时,若Cd(OH)2和Ni(OH)2耗尽后继续充电,会造成安全隐患,称为过度充电。制造电池时,在镉电极加入过量的Cd(OH)2可对电池进行过度充电保护,该方法称为镉氧循环法。
(5) Cd(OH)2耗尽后继续充电,镉电极上生成的物质为____。
(6)已知:①隔膜可以透过阴离子和分子:②O2可以与Cd发生反应生成Cd(OH)2。请结合两个电极上的电极反应式说明用镉氧循环法实现过度充电保护的原理:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属(M)–空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH) n。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是

A. 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B. 比较Mg、Al、Zn三种金属–空气电池,Al–空气电池的理论比能量最高
C. M–空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne–=4M(OH)n
D. 在M–空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·天津卷)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第二阶段,Ni(CO)4分解率较低
C. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组为测定放置已久的小苏打样品中纯碱的质量分数,设计如下实验方案:
(1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称取剩余固体质量,计算。
①完成本实验需要不断用玻璃棒搅拌,其目的是_______________________________。
②若实验前所称样品的质量为m g,加热至恒重时固体质量为a g,则样品中纯碱的质量分数为________。
(2)方案二:按如图所示装置进行实验,并回答下列问题:
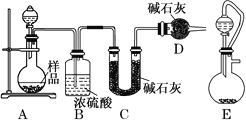
①实验前先检查装置的气密性,并称取一定质量的样品放入A中,将稀硫酸装入分液漏斗中。D装置的作用是________________。
②实验中除称量样品质量外,还需分别称量_______装置反应前、后质量(填装置字母代号)。
③根据此实验得到的数据,测定结果有误差。因为实验装置还存在一个明显的缺陷,该缺陷是_________。
④有同学认为,用E装置替代A装置能提高实验准确度。你认为是否正确?_________(填“是”或“否”)。
(3)方案三:称取一定量的样品置于锥形瓶中,加适量水,用盐酸进行滴定,从开始至有气体产生到气体不再产生,所滴加的盐酸体积如图所示,则小苏打样品中纯碱的质量分数为_________(保留两位有效数字)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com