
【题目】在![]() 时,FeS的
时,FeS的![]() ,CuS的
,CuS的![]() ,ZnS的
,ZnS的![]() 常温时下列有关说法中正确的是( )
常温时下列有关说法中正确的是( )
A.FeS的溶解度大于CuS的溶解度
B.饱和CuS溶液中![]() 的浓度为
的浓度为![]()
![]()
C.向物质的量浓度相同的![]() 、
、![]() 的混合液中加入少量
的混合液中加入少量![]() ,只有FeS沉淀生成
,只有FeS沉淀生成
D.向饱和ZnS溶液中加入少量![]() 固体,ZnS的
固体,ZnS的![]() 变大
变大
科目:高中化学 来源: 题型:
【题目】我国传统中药金银花具有清咽润喉、增强免疫调节的作用,其中的一种有效成分为绿原酸,结构简式如下图所示:
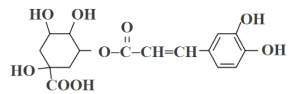
回答下列问题:
(1)绿原酸的分子式为_______________。
(2)1mol绿原酸能与_______molNaOH完全反应,1mol绿原酸能与______molH2完全加成。
(3)咖啡豆中含有绿原酸,烘焙手法对咖啡风味的影响可以用下图解释:
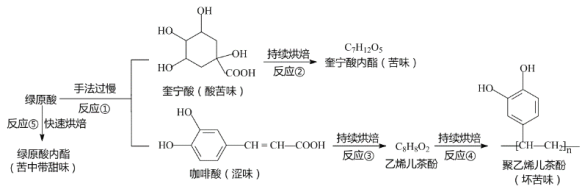
①上述反应中属于酯化反应的是___________(填序号)。
②写出乙烯儿茶酚(C8H8O2)的结构简式____________。
③写出反应③的方程式______________。
④写出符合下列要求的乙烯儿茶酚的同分异构体结构简式______________。
I.苯环上有两个取代基 II.能够与碳酸氢钠反应生成气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.利用甲烷催化还原NOx消除氮氧化物的污染
①CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=-574kJ·mol-1
②CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) ΔH2=-1 160kJ·mol-1
2N2(g)+CO2(g)+2H2O(g) ΔH2=-1 160kJ·mol-1
③CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) ΔH3=-867kJ·mol-1
N2(g)+CO2(g)+2H2O(g) ΔH3=-867kJ·mol-1
(1)如果三个反应的平衡常数依次为K1、K2、K3,则K3=___(用K1、K2表示)。
(2)在2L恒容密闭容器中充入1molCH4和2molNO2进行反应③,CH4的平衡转化率α(CH4)与温度和压强的关系如图所示。
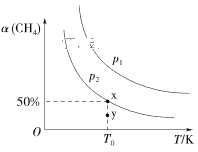
①若容器中的压强为p2,y点:v正____(填“大于”“等于”或“小于”)v逆。
②x点对应温度下反应的平衡常数K=___。
Ⅱ.甲烷蒸气转化法制H2的主要反应为:CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
(3)在恒容密闭容器中充入2 mol CH4和H2O(g)的混合气体,且CH4和H2O(g)的物质的量之比为x,相同温度下达到平衡时测得H2的体积分数φ(H2)与x的关系如图所示。
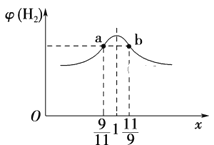
则CH4的转化率:a点____(填“>”“=”或“<”,下同)b点,CH4(g)的浓度:a点_____b点,氢气的产率:a点____b点。
Ⅲ.(4)根据以下三个热化学方程式:2H2S(g)+3O2(g)=SO2(g) +2H2O(l) ΔH=-Q1kJ·mol-1,2H2S(g)+O2(g)= S(s)+2H2O(l) ΔH=-Q2kJ·mol-1,2H2S(g)+O2(g)= S(s)+2H2O(g) ΔH=-Q3kJ·mol-1,判断Q1、Q2、Q3的大小关系是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pC类似pH,是指稀溶液中溶质物质的量浓度的负对数。如某溶液溶质的浓度为1×10-3mol/L,则该溶液中溶质的pC=3。下列叙述正确的是
A.某温度下,任何电解质的稀溶液中,pC(H+)![]() pC(OH-)
pC(OH-)![]()
B.0.01mol/L的CaCl2溶液中逐滴加入纯碱溶液,滴加过程中pC(Ca2+)逐渐增大
C.0.01mol/L的BaCl2溶液中,pC(Cl-)![]() 2pC(Ba2+)
2pC(Ba2+)
D.用0.01mol/L的盐酸滴定某浓度的NaOH溶液,NaOH溶液的pC(OH-)逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关甲、乙、丙、丁四个图示的叙述正确的是( )
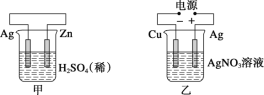
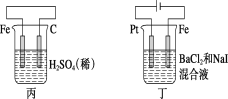
A.甲中负极反应式为2H++2e-=H2↑
B.乙中阳极反应式为Ag++e-=Ag
C.丙中H+向碳棒方向移动
D.丁中电解开始时阳极产生黄绿色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于工业生产说法正确的是![]()
A.氯碱工业中的阳离子交换膜阻止阳离子通过
B.在硫酸工业、合成氨工业、硝酸工业中,均必须对尾气进行吸收处理
C.工业上均用电解熔融氧化物的方法制金属镁和铝
D.在侯氏制碱工业中,向饱和氯化钠溶液中先通氨气,后通二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀有金属铟由于其良好的性能常用于生产液晶显示器和平板屏幕,下图是铟元素的相关信息,下列有关铟的说法错误的是
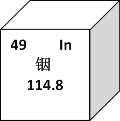
A. 115In原子核内有66个中子
B. 115In原子核外有49个电子
C. 115In、113In互为同位素
D. 115In、113In的化学性质有较大的不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl22H2O的流程如下:
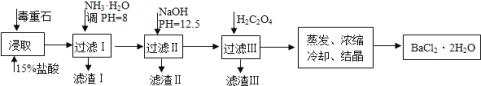
(1)写出“浸取”环节发生的主要离子方程式______。实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的______。(双选,填选项字母)
a.烧杯b.容量瓶c.滴定管d.玻璃棒
(2)下图是一些难溶氢氧化物在不同pH下的沉淀一溶解图
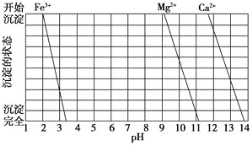
已知:Ksp(BaC2O4)= 1.6×10-7, Ksp(CaC2O4)= 2.3×10-9,
①滤渣I中含_____(填化学式)。再加入NaOH调节pH=12.5可除去______(填离子符号)
②加入H2C2O4应避免过量的原因是________
(3)25℃,H2C2O4的电离平衡常数如下:
H2C2O4 | Ka1=5.36×10-2 | Ka2=5.35×10-5 |
①HC2O4-的电离平衡常数表达式Ka2=__________
②NaHC2O4溶液呈_______(酸性、碱性、中性)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.1g氢气在氧气中完全燃烧生成气态水,放出的热量为120.9kJ,氢气的燃烧热大于241.8kJmol-1
B.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放出的热量为19.3kJ,其热化学方程式为N2(g)+3H2(g)=2NH3(g)ΔH=﹣38.6kJ·mol-1
C.常温下,若反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的ΔH>0
D.已知中和热为57.3kJ·mol-1,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量要大于57.3kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com