
【题目】如图是部分短周期主族元素原子半径与原子序数的关系图。下列说法错误的是![]()
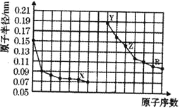
A.X、Y两种单质在常温下反应生成的产物为碱性氧化物
B.![]() 可由
可由![]() 和
和![]() 的溶液反应制取
的溶液反应制取
C.Y、Z、R三种元素对应的最高价氧化物的水化物相互之间可以发生反应
D.电解熔融的X与Z构成的化合物可以得到单质Z
【答案】B
【解析】
同周期元素从左往右,原子半径依次减小,同主族元素从上到下,原子半径依次增大,故前7种元素处于第二周期,后7种元素处于第三周期,由原子序数可知,X为O元素,Y为Na元素,Z为Al元素,R为S元素。
A.X、Y两种单质在常温下反应生成的产物为氧化钠,能和酸反应只生成盐和水的氧化物为碱性氧化物,氧化钠和酸反应只生成盐和水,则氧化钠是碱性氧化物,故A正确;
B.![]() 可在水溶液中易发生双水解,所以不能在水溶液中制取硫化铝,故B错误;
可在水溶液中易发生双水解,所以不能在水溶液中制取硫化铝,故B错误;
C.Y、Z、R三种元素对应的最高价氧化物的水化物分别是NaOH、![]() 、
、![]() ,氢氧化铝是两性氢氧化物,能和酸、碱反应生成盐和水,氢氧化钠和稀硫酸发生中和反应,所以Y、Z、R三种元素对应的最高价氧化物的水化物相互之间可以发生反应,故C正确;
,氢氧化铝是两性氢氧化物,能和酸、碱反应生成盐和水,氢氧化钠和稀硫酸发生中和反应,所以Y、Z、R三种元素对应的最高价氧化物的水化物相互之间可以发生反应,故C正确;
D.X、Z构成的化合物是氧化铝,铝是亲氧元素,较活泼,工业上用电解熔融氧化铝的方法冶炼铝,故D正确。
故选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】维生素P的结构如图所示,其中R为烷烃基。下列关于维生素P的叙述正确的是
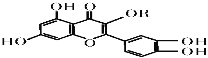
A.分子中的官能团有羟基、碳碳双键、醚键、酯基
B.若R为甲基,则该物质的分子式可以表示为C16H12O7
C.1 mol该化合物最多可消耗NaOH 为5mol
D.1 mol该化合物最多消耗溴水中的溴5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,水溶液中![]() 和
和![]() 的浓度变化曲线如图所示,下列说法正确的是
的浓度变化曲线如图所示,下列说法正确的是![]()

A.升高温度,可能引起由a向b的变化
B.该温度下,水的离子积常数为![]()
C.该温度下,向水中加入![]() 固体可能引起由b向a的变化
固体可能引起由b向a的变化
D.稀释该温度下某溶液可引起由b向c的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是生命之源,与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)H2O水分子的VSEPR模型为_______形,氧原子的杂化方式为_____
(2)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+),用电子式表示它的形成过程为___________________________,
(3)对于(2)中涉及的变化过程的描述不合理的是________。
a.氧原子的杂化类型发生了改变 b.微粒的形状发生了改变
c.微粒的化学性质发生了改变 d.微粒中的键角发生了改变
(4)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol(设气态水中无氢键)。
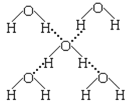
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,pH=2的HA和HB各1 mL分别加水稀释,pH随溶液体积变化如图所示。下列叙述正确的是

A. Kw的数值:a点大于c点
B. 溶液中的总酸量:a点大于b点
C. HB的电离程度:b点大于c点
D. 将a点与b点两溶液同时升高温度,则![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)已知X、Y、Z、M、G、Q是六种短周期元素,原子序数依次增大。X、Z、Q的单质在常温下呈气态;Y的原子最外层电子数是其电子层数的2倍;X与M同主族;Z、G分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)Y、Z、M、G四种元素原子半径由大到小的顺序是(写元素符号) 。
(2)Z在元素周期表中的位置为 。
(3)上述元素的最高价氧化物对应的水化物酸性最强的是(写化学式) 。
(4)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式) ,在实验室中,制取该物质的反应原理是(写化学方程式) 。
(5)M2Z的电子式为 。MX与水反应可放出气体,该反应的化学方程式为 。
(6)常温下,不能与G的单质发生反应的是(填序号) 。
a.CuSO4溶液 b.Fe2O3c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
工业上用电解法制G的单质的化学方程式是 ,若以石墨为电极,阳极产生的混合气体的成分是(写化学式) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中微粒的物质的量浓度关系不正确的是![]()
A.若将适量![]() 通入
通入![]()
![]()
![]() 溶液中至溶液恰好呈中性,则溶液中
溶液中至溶液恰好呈中性,则溶液中![]() 不考虑溶液体积变化
不考虑溶液体积变化![]() :2
:2![]()
![]()
![]()
B.某溶液中由水电离出的![]() ,若
,若![]() 时,则该溶液pH一定为
时,则该溶液pH一定为![]()
C.常温下将相同体积的![]() 硫酸和
硫酸和![]() 一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性
一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性
D.等体积等物质的量浓度的NaClO溶液与NaCl溶液中离子总数大小:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.300℃时将2molA和2molB两种气体混合于2L密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g) △H,2min末达到平衡,生成0.8moLD。
(1)300℃时,该反应的平衡常数表达式为K=________,已知K300℃<K350℃,则△H________(填“>”或“<” 0).
(2)在2min末时,B的平衡浓度为________,D的平均反应速率为________。
(3)若温度不变,缩小容器容积,则A的转化率________![]() 填“增大”“减小”或“不变”
填“增大”“减小”或“不变”![]() 。
。
II.在一定条件下,可逆反应:mA+nBpC达到平衡,若:
(1)A、B、C都是气体,减小压强,平衡向正反应方向移动,则,m+n________(填“>”“<”或“![]() ” p)。
” p)。
(2)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是________。
(3)加热后,可使C的质量增加,则正反应是________(填“放热”或“吸热”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠的用途很广,可用做冶金、纺织、漂染等工业的基本原料.请根据题意回答下列问题:
Ⅰ![]() 世界最早工业生产碳酸钠的方法是路布兰
世界最早工业生产碳酸钠的方法是路布兰![]() 法.其流程如下:
法.其流程如下:

流程I的另一产物是____________,流程Ⅱ的反应分步进行:
![]()
![]()
![]() ;
;
![]() 与石灰石发生复分解反应,总反应方程式可表示为____________.
与石灰石发生复分解反应,总反应方程式可表示为____________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com