
【题目】下列溶液中微粒的物质的量浓度关系不正确的是![]()
A.若将适量![]() 通入
通入![]()
![]()
![]() 溶液中至溶液恰好呈中性,则溶液中
溶液中至溶液恰好呈中性,则溶液中![]() 不考虑溶液体积变化
不考虑溶液体积变化![]() :2
:2![]()
![]()
![]()
B.某溶液中由水电离出的![]() ,若
,若![]() 时,则该溶液pH一定为
时,则该溶液pH一定为![]()
C.常温下将相同体积的![]() 硫酸和
硫酸和![]() 一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性
一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性
D.等体积等物质的量浓度的NaClO溶液与NaCl溶液中离子总数大小:![]()
【答案】B
【解析】
A、依据反应过程和溶液中存在的电荷守恒分析判断;
B、常温时,某溶液中由水电离出的![]()
![]() ,若
,若![]() 时,说明水的电离受到抑制,可能为酸溶液,也可能为碱溶液;
时,说明水的电离受到抑制,可能为酸溶液,也可能为碱溶液;
C、碱的强弱不知,若为强酸、强碱混合,呈中性,若为强酸、弱碱混合,则相同体积的![]() 硫酸和
硫酸和![]() 一元碱BOH溶液混合显碱性;
一元碱BOH溶液混合显碱性;
D、HClO是弱酸,所以NaClO溶液中发生水解反应:![]() ,使溶液呈碱性,氢离子浓度小于
,使溶液呈碱性,氢离子浓度小于![]() ,所以NaCl溶液中
,所以NaCl溶液中![]() 大于NaClO溶液中
大于NaClO溶液中![]() ,依据电荷守恒分析。
,依据电荷守恒分析。
A、将![]() 通入
通入![]()
![]() 溶液中恰好呈中性,溶液中存在电荷守恒,
溶液中恰好呈中性,溶液中存在电荷守恒,![]() ,
,![]() ,则得到
,则得到![]() ,故A正确;
,故A正确;
B.常温时,某溶液中由水电离出的![]()
![]() ,若
,若![]() 时,说明水的电离受到抑制,可能为酸溶液,也可能为碱溶液,如为酸溶液,则
时,说明水的电离受到抑制,可能为酸溶液,也可能为碱溶液,如为酸溶液,则![]() ,如为碱溶液,则
,如为碱溶液,则![]() ,故B错误;
,故B错误;
C、![]() 硫酸,
硫酸,![]() ,硫酸完全电离,
,硫酸完全电离,![]() 一元碱BOH,
一元碱BOH,![]() ,若为强酸、强碱混合,混合后溶液呈中性,若为强酸、弱碱混合,氢离子和氢氧根离子正好反应生成盐和水,而弱碱存在电离平衡,平衡右移,还可以继续电离出氢氧根离子,所以溶液呈碱性,故C正确;
,若为强酸、强碱混合,混合后溶液呈中性,若为强酸、弱碱混合,氢离子和氢氧根离子正好反应生成盐和水,而弱碱存在电离平衡,平衡右移,还可以继续电离出氢氧根离子,所以溶液呈碱性,故C正确;
D、HClO是弱酸,所以NaClO溶液中发生水解反应:![]() ,使溶液呈碱性,氢离子浓度小于
,使溶液呈碱性,氢离子浓度小于![]() ,所以NaCl溶液中
,所以NaCl溶液中![]() 大于NaClO溶液中
大于NaClO溶液中![]() ,根据电荷守恒:
,根据电荷守恒:![]() 可得溶液中离子总数为
可得溶液中离子总数为![]() ;同理可得NaClO溶液中总数为
;同理可得NaClO溶液中总数为![]() ,所以NaCl溶液中离子总数大于NaClO溶液,故D正确;
,所以NaCl溶液中离子总数大于NaClO溶液,故D正确;
故选:B。


科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:2SO2(g)+O2(g)![]() 2SO3(g)( 正反应放热),如图是某次实验的化学反应速率随时间变化的图像,推断在t1时刻突然变化的条件可能是( )
2SO3(g)( 正反应放热),如图是某次实验的化学反应速率随时间变化的图像,推断在t1时刻突然变化的条件可能是( )
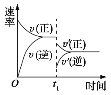
A.降低体系温度B.减小生成物的浓度
C.催化剂失效D.增大容器的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
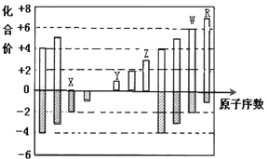
A. 原子半径:Z>Y>X
B. Y和Z两者最高价氧化物对应水化物能相互反应
C. WX3和水反应形成的化合物是离子化合物
D. 气态氢化物的稳定性:R<W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期主族元素原子半径与原子序数的关系图。下列说法错误的是![]()
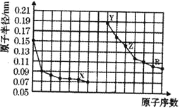
A.X、Y两种单质在常温下反应生成的产物为碱性氧化物
B.![]() 可由
可由![]() 和
和![]() 的溶液反应制取
的溶液反应制取
C.Y、Z、R三种元素对应的最高价氧化物的水化物相互之间可以发生反应
D.电解熔融的X与Z构成的化合物可以得到单质Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是盛放液溴的试剂瓶剖面图,仔细观察分成了明显的气相、溴溶液相和液溴相三相,下列说法错误的是( )

A.气相呈现红棕色,因为其中含有Br2的蒸汽
B.溴溶液相中显酸性,主要因为HBr电离出了H![]()
C.液溴保存时加水形成水封的目的是减少Br2的挥发
D.液溴保存时不可敞口放置,应保存在细口瓶中并塞上橡胶塞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
A.0.1 mol·L-1 CH3COONa溶液与0.1 mol·L-1 HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-)
B.0.1 mol·L-1 NH4Cl溶液与0.1 mol·L-1氨水等体积混合(pH>7):c(NH3·H2O)>c(NH![]() )>c(Cl-)>c(OH-)
)>c(Cl-)>c(OH-)
C.0.1 mol·L-1 Na2CO3溶液与0.1 mol·L-1 NaHCO3溶液等体积混合:![]() c(Na+)=c(CO
c(Na+)=c(CO![]() )+c(HCO
)+c(HCO![]() )+c(H2CO3)
)+c(H2CO3)
D.0.1 mol·L-1 Na2C2O4溶液与0.1 mol·L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O![]() )+c(HC2O
)+c(HC2O![]() )+c(OH-)=c(Na+)+c(H+)
)+c(OH-)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ni(CO)4可用于有机合成,也常用作催化剂。一定条件下,恒容密闭容器中发生反应Ni(s)+4CO(g)![]() Ni(CO)4(g),该反应的平衡常数与温度的关系如下表所示:
Ni(CO)4(g),该反应的平衡常数与温度的关系如下表所示:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法正确的是
A.25℃达到平衡时,向容器中继续充入CO(g),CO的转化率减小
B.温度越低,越有利于Ni(CO)4的生产
C.80℃时,测得某时刻Ni(CO)4、CO的浓度均为0.5 mol·L-1,则此时v正<v逆
D.平衡后,向密闭容器中加入少量镍粉,平衡正向移动,达到新平衡时CO的浓度比原平衡小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列说法正确的是![]()
A.分别中和pH相同的等体积的盐酸和醋酸溶液,消耗等量的NaOH
B.![]() 的
的![]() 溶液加水稀释
溶液加水稀释![]() 倍后,
倍后,![]()
C.pH相等的![]() 、NaOH溶液中,水的电离程度相同
、NaOH溶液中,水的电离程度相同
D.![]() 溶液中:
溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①![]() 是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2
是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH;③已知乳酸E的结构简式为
2CH3COOH;③已知乳酸E的结构简式为![]() 。现以A为主要原料合成乙酸乙酯,其合成路线如图所示:
。现以A为主要原料合成乙酸乙酯,其合成路线如图所示:
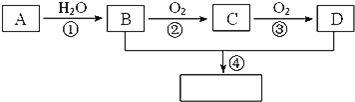
回答下列问题:
(1)A的电子式 ______,A结构简式______。
(2)B的结构简式 ______,D的结构简式 ______。
(3)B和D的分子中分别含 ______和______两种官能团(写名称)。
(4)写出下列反应的化学方程式并注明反应类型:
A→B ______; ______。
B→C______; ______。
B和D反应生成乙酸乙酯的反应并注明反应类型:______; ______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com