
【题目】已知:①![]() 是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2
是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH;③已知乳酸E的结构简式为
2CH3COOH;③已知乳酸E的结构简式为![]() 。现以A为主要原料合成乙酸乙酯,其合成路线如图所示:
。现以A为主要原料合成乙酸乙酯,其合成路线如图所示:
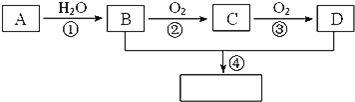
回答下列问题:
(1)A的电子式 ______,A结构简式______。
(2)B的结构简式 ______,D的结构简式 ______。
(3)B和D的分子中分别含 ______和______两种官能团(写名称)。
(4)写出下列反应的化学方程式并注明反应类型:
A→B ______; ______。
B→C______; ______。
B和D反应生成乙酸乙酯的反应并注明反应类型:______; ______。
【答案】![]() CH2=CH2 CH3CH2OH CH3COOH 羟基 羧基 CH2=CH2+H2O
CH2=CH2 CH3CH2OH CH3COOH 羟基 羧基 CH2=CH2+H2O![]() CH3CH2OH 加成反应 2CH3CH2OH+O2
CH3CH2OH 加成反应 2CH3CH2OH+O2![]() 2CH3CHO+2H2O 氧化反应 CH3CH2OH+CH3COOH
2CH3CHO+2H2O 氧化反应 CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O 酯化反应(或取代反应)
CH3COOCH2CH3+H2O 酯化反应(或取代反应)
【解析】
A的产量通常用来衡量一个国家的石油化工水平,A为CH2=CH2,与水发生加成反应生成B为CH3CH2OH,B被氧化生成C为CH3CHO,C被氧化生成D为CH3COOH,CH3CH2OH与CH3COOH发生酯化反应生成乙酸乙酯,结合有机物的结构和性质解答该题。
根据上述分析可知:A为CH2=CH2,B为CH3CH2OH,C为CH3CHO,D为CH3COOH,CH3CH2OH与CH3COOH发生酯化反应生成乙酸乙酯CH3COOCH2CH3。
(1)A为乙烯,分子中两个C原子形成2对共用电子对,每个C原子再分别与2个H原子形成2对共用电子对,所以乙烯的电子式为![]() ,结构简式为CH2=CH2;
,结构简式为CH2=CH2;
(2)根据前面的分析可知,B为CH3CH2OH,D为CH3COOH;
(3)B为CH3CH2OH,物质含有的官能团为羟基;D为CH3COOH,分子中含有的官能团名称为羧基;
(4)A→B是乙烯和水在催化作用下加成反应生成乙醇,反应的方程式为CH2=CH2+H2O![]() CH3CH2OH,反应类型为加成反应;B→C为乙醇在催化剂作用下发生催化氧化生成乙醛,反应的方程式为2CH3CH2OH+O2
CH3CH2OH,反应类型为加成反应;B→C为乙醇在催化剂作用下发生催化氧化生成乙醛,反应的方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O,反应类型为氧化反应;乙醇与乙酸发生酯化反应生成乙酸乙酯,反应的方程式为CH3CH2OH+CH3COOH
2CH3CHO+2H2O,反应类型为氧化反应;乙醇与乙酸发生酯化反应生成乙酸乙酯,反应的方程式为CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O,反应类型为酯化反应,酯化反应也属于取代反应。
CH3COOCH2CH3+H2O,反应类型为酯化反应,酯化反应也属于取代反应。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列溶液中微粒的物质的量浓度关系不正确的是![]()
A.若将适量![]() 通入
通入![]()
![]()
![]() 溶液中至溶液恰好呈中性,则溶液中
溶液中至溶液恰好呈中性,则溶液中![]() 不考虑溶液体积变化
不考虑溶液体积变化![]() :2
:2![]()
![]()
![]()
B.某溶液中由水电离出的![]() ,若
,若![]() 时,则该溶液pH一定为
时,则该溶液pH一定为![]()
C.常温下将相同体积的![]() 硫酸和
硫酸和![]() 一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性
一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性
D.等体积等物质的量浓度的NaClO溶液与NaCl溶液中离子总数大小:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种白色晶体,能潮解,难溶于水,可与水缓慢反应,不溶于乙醇,易与酸反应,常用作杀菌剂、防腐剂等。根据题意,回答相关问题。
I.CaO2晶体的制备:CaO2晶体通常可利用CaCl2在碱性条件下与H2O2反应制得。某化学兴趣小组在实验室制备CaO2的实验方案和装置示意图如下:
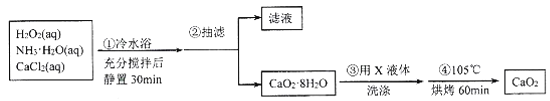

(1)三颈烧瓶中发生的主要反应的化学方程式为___________。
(2)冷水浴的目的是__;步骤③中洗涤CaO2·8H2O的实验操作方法是__
Ⅱ.CaO2含量的测定:测定CaO2样品纯度的方法是:称取0.200g样品于锥形瓶中,加入50mL水和15mL2mol·L-lHCl,振荡使样品溶解生成过氧化氢,再加入几滴MnCl2稀溶液,立即用0.0200mol·L-lKMnO4标准溶液滴定到终点,消耗25.00mL标准液。
(3)上述过程中使用稀盐酸而不使用稀硫酸溶解样品的原因是______;滴定前加入MnCl2稀溶液的作用可能是______。
(4)滴定过程中的离子方程式为____,样品中CaO2的质量分数为____。
(5)实验I制得的晶体样品中CaO2含量偏低的可能原因是:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠的用途很广,可用做冶金、纺织、漂染等工业的基本原料.请根据题意回答下列问题:
Ⅰ![]() 世界最早工业生产碳酸钠的方法是路布兰
世界最早工业生产碳酸钠的方法是路布兰![]() 法.其流程如下:
法.其流程如下:

流程I的另一产物是____________,流程Ⅱ的反应分步进行:
![]()
![]()
![]() ;
;
![]() 与石灰石发生复分解反应,总反应方程式可表示为____________.
与石灰石发生复分解反应,总反应方程式可表示为____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】垃圾是放错地方的资源,工业废料也可以再利用。某化学兴趣小组在实验室中用废弃的含铝、铁、铜的合金制取硫酸铝溶液、硝酸铜晶体和铁红(Fe2O3)。实验方案如下:

(1)写出滤液A中加入足量硫酸后所发生反应的离子方程式:__________________。
(2)已知Fe(OH)3沉淀的pH是3~4,溶液C通过调节pH可以使Fe3+沉淀完全。下列物质中可用作调整溶液C的pH的试剂是________(填序号)。
A.铜粉 | B.氨水 | C.氢氧化铜 | D.碳酸铜 |
(3)常温,若溶液C中金属离子均为1 mol·L-1,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20。控制pH=4,溶液中c(Fe3+)=____________,此时________Cu(OH)2沉淀生成(填“有”或“无”)。
(4)将20 mL Al2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液80 mL混合,反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究人员利用![]() 水解生成的盐酸和石灰石
水解生成的盐酸和石灰石![]() 含少量
含少量![]() 、
、![]() 、
、![]() 、
、![]() 杂质
杂质![]() 生产医用二水合氯化钙晶体的简化工艺流程为图1:
生产医用二水合氯化钙晶体的简化工艺流程为图1:
已知:![]() 、
、![]() 完全沉淀的pH分别是
完全沉淀的pH分别是![]() 、
、![]() .
.
回答下列问题:
(1)滤渣A的主要成分是____________;操作X的方法为____________.
(2)控制在![]() 时
时![]() 水解的化学方程式为____________.
水解的化学方程式为____________.
(3)![]() 含80%CaCCO3的石灰石理论上最多能生成
含80%CaCCO3的石灰石理论上最多能生成![]() 的质量为____________t,制得的二水合氯化钙晶体中存在的少量杂质可能是____________.
的质量为____________t,制得的二水合氯化钙晶体中存在的少量杂质可能是____________.
(4)尾气中含污染气体![]() ,利用图2所示电化学装置可吸收
,利用图2所示电化学装置可吸收![]() 气体,从而减少大气污染,阳极的电极反应式为____________.
气体,从而减少大气污染,阳极的电极反应式为____________.

(5)制二水合氯化钙晶体所需热量可由甲醇燃烧提供,如图3为一定条件下![]() 与
与![]() 发生反应时,生成CO、
发生反应时,生成CO、![]() 或HCHO的能量变化图
或HCHO的能量变化图![]() 反应物
反应物![]() 和生成物
和生成物![]() 已略去
已略去![]() 则
则![]() 的
的![]() ____________.
____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化氢(PH3)是一种剧毒气体,是常用的高效熏蒸杀虫剂,也是一种电子工业原料.
(1)在密闭粮仓放置的磷化铝(AIP)片剂,遇水蒸气放出PH3气体,化学方程式为 ______
(2)利用反应PH3+3HgCl2=P(HgCl)3↓+3HCl,通过测定溶液 ______ 变化,可准确测定空气中微量的PH3;其中HgCl2溶于水,所得溶液几乎不导电,则HgCl2属于 ______ (填“共价”或“离子”)化合物.
(3)工业制备PH3的流程如图1所示:

①亚磷酸属于 ______ 元酸;
②当反应I生成的n(NaH2PO2):n(Na2HPO3)=3:1时,参加反应的n(P4):n(NaOH)= ______ .
(4)用漂白粉可将PH3氧化为H3PO4,化学方程式为 ______ ;含有水蒸气时可加快PH3的氧化过程,用离子方程式表示原因: ______ .
(5)从(4)中的反应产物中回收磷酸氢钙(CaHPO4)的方法如图2:

①试剂X为 ______ (填化学式);
②已知25℃时,H3PO4的Ka1=7.5×10-3、Ka2=6.3×10-8、Ka3=4.4×10-13.
CaHPO4悬浊液pH ______ 7(填“>”、“=”或“<”),通过计算说明理由 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丙基乙烯(VCP)结构为![]() ,下列关于该物质说法不正确的是
,下列关于该物质说法不正确的是
A.环丙基乙烯属于烃类
B.该物质能发生取代反应、加成反应、聚合反应、氧化反应
C.环丙基乙烯与环戊二烯 (![]() )互为同分异构体
)互为同分异构体
D.环丙基乙烯的一氯代物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、M、N六种主族元素,它们在周期表中位置如图所示,下列说法不正确的是

A.X的原子半径比Y的大
B.元素的非金属性:W>Z
C.氧化物对应水化物的酸性M>Z
D.元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com