
【题目】垃圾是放错地方的资源,工业废料也可以再利用。某化学兴趣小组在实验室中用废弃的含铝、铁、铜的合金制取硫酸铝溶液、硝酸铜晶体和铁红(Fe2O3)。实验方案如下:

(1)写出滤液A中加入足量硫酸后所发生反应的离子方程式:__________________。
(2)已知Fe(OH)3沉淀的pH是3~4,溶液C通过调节pH可以使Fe3+沉淀完全。下列物质中可用作调整溶液C的pH的试剂是________(填序号)。
A.铜粉 | B.氨水 | C.氢氧化铜 | D.碳酸铜 |
(3)常温,若溶液C中金属离子均为1 mol·L-1,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20。控制pH=4,溶液中c(Fe3+)=____________,此时________Cu(OH)2沉淀生成(填“有”或“无”)。
(4)将20 mL Al2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液80 mL混合,反应的离子方程式为_______________。
【答案】AlO2-+4H+=Al3++2H2O CD 4.0×10-8 无 2Al3++3SO42-+3Ba2++8OH-=3BaSO4↓+2AlO2-+4H2O
【解析】
(1)铁、铜与氢氧化钾不反应,则滤渣B是铁、铜的混合物。滤液A中含有偏铝酸钾和过量的氢氧化钾,因此加入足量硫酸后所发生反应的离子方程式为AlO2-+4H+=Al3++2H2O。
(2)由于不能引入新的杂质,则调节溶液C的pH值时需要用氢氧化铜或碳酸铜,答案选CD。
(3)常温,若溶液C中金属离子均为1 mol·L-1,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20。控制pH=4,则溶液中氢氧根离子的浓度为1.0×10-10,所以溶液中c(Fe3+)=![]() =4.0×10-8mol/L,此时(1.0×10-10)2×1<2.2×10-20,所以无Cu(OH)2沉淀生成。
=4.0×10-8mol/L,此时(1.0×10-10)2×1<2.2×10-20,所以无Cu(OH)2沉淀生成。
(4)将20 mL Al2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液80 mL混合,二者的物质的量之比是1:4,所以反应的离子方程式为2Al3++3SO42-+3Ba2++8OH-=3BaSO4↓+2AlO2-+4H2O。


科目:高中化学 来源: 题型:
【题目】如图是盛放液溴的试剂瓶剖面图,仔细观察分成了明显的气相、溴溶液相和液溴相三相,下列说法错误的是( )

A.气相呈现红棕色,因为其中含有Br2的蒸汽
B.溴溶液相中显酸性,主要因为HBr电离出了H![]()
C.液溴保存时加水形成水封的目的是减少Br2的挥发
D.液溴保存时不可敞口放置,应保存在细口瓶中并塞上橡胶塞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们要持之以恒,建设天蓝、地绿、水清的中国。水处理技术在生活、生产中应用广泛,对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(1)①生活用水必须保证安全,自来水厂需要对取自江河湖泊中的淡水进行a.杀毒灭菌,b.混凝沉淀,c.过滤等工艺处理,这三项处理的正确顺序是 ______ (填字母)
②下列试剂能够用来对自来水进行杀菌消毒,且不会造成二次污染的是 ______ (填字母)
a.福尔马林 b.漂白粉 c.氯气 d.臭氧
③石灰纯碱法是常用的硬水软化方法.已知25![]() 时Ksp=2.8×10-9,现将等体积的Ca(OH)2溶液与Na2CO3溶液混合(假设溶液体积具有加和性),若Na2CO3溶液的浓度为5.6×10-5molL-1,则生成沉淀所需Ca(OH)2溶液的最小浓度为 ______ 。
时Ksp=2.8×10-9,现将等体积的Ca(OH)2溶液与Na2CO3溶液混合(假设溶液体积具有加和性),若Na2CO3溶液的浓度为5.6×10-5molL-1,则生成沉淀所需Ca(OH)2溶液的最小浓度为 ______ 。
(2)金属铬污染环境,其主要来源于冶金、水泥等工业产生的废水。某兴趣小组拟定以下流程,对Cr3+、Fe2+等离子的废水进行无公害处理
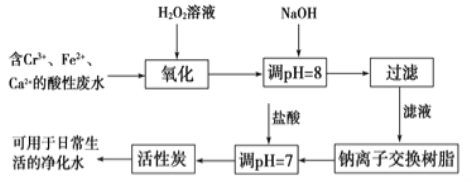
请回答下列问题
①写出加入双氧水后发生反应的离子方程式:____________________ ;
②过滤操作需要的玻璃仪器是烧杯、漏斗、 ______ ;
③活性炭的作用是 _________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是以环戊烷为原料制备环戊二烯的合成路线,下列说法正确的是( )
![]()
A. ![]() 的结构简式为
的结构简式为![]()
B. 反应④的反应试剂和反应条件是浓![]() 加热
加热
C. ①②③的反应类型分别为卤代、水解、消去
D. 环戊二烯与![]() 以1∶1的物质的量之比加成可生成
以1∶1的物质的量之比加成可生成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4molA气体和2molB气体充入到1L的密闭容器中,在一定条件下发生如下反应:2A(g)+ B(g)2C(g)。经2s后达到平衡时,测得C的物质的量为1.2 mol。下列说法中正确的是
A.平衡时,A物质的浓度为2.8 mol·L-1
B.平衡时,B的转化率为70%
C.反应后混合气体的总物质的量为5.2mol
D.用C表示平均反应速率为1.2mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①![]() 是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2
是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH;③已知乳酸E的结构简式为
2CH3COOH;③已知乳酸E的结构简式为![]() 。现以A为主要原料合成乙酸乙酯,其合成路线如图所示:
。现以A为主要原料合成乙酸乙酯,其合成路线如图所示:
回答下列问题:
(1)A的电子式 ______,A结构简式______。
(2)B的结构简式 ______,D的结构简式 ______。
(3)B和D的分子中分别含 ______和______两种官能团(写名称)。
(4)写出下列反应的化学方程式并注明反应类型:
A→B ______; ______。
B→C______; ______。
B和D反应生成乙酸乙酯的反应并注明反应类型:______; ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒容密闭容器中发生反应:SiO2(s)+4HF(g)![]() SiF4(g)+2H2O(g)+148.9 kJ。叙述错误的是
SiF4(g)+2H2O(g)+148.9 kJ。叙述错误的是
A. 反应物的总能量高于生成物的总能量
B. 若生成2mol液态水,则放出的热量大于148.9 kJ
C. 当v正(HF)=2v逆(H2O)时,反应达到平衡状态
D. 平衡后放出的热量随加入SiO2量的增加而增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。下列说法正确的是( )
2SO3(g) ΔH<0。下列说法正确的是( )
A.达到平衡后,升高温度平衡正向移动B.达到平衡时:v(O2)=2v(SO2)
C.达到平衡后,降低温度O2的浓度将减小D.升高温度,正反应速率增加,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加,由这些元素组成的常见物质的转化关系如下图,其中a、b、d、g为化合物,a为淡黄色固体,c是Z的单质,该单质与沸水缓慢反应,且该单质可制造照明弹;f为固体单质。下列有关说法正确的是

A. 简单离子的半径:Y>Z>X B. 元素的非金属性:W>X
C. 最高价氧化物对应水化物的碱性:Y>Z D. X、Y两种元素组成的化合物只含离子键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com