
【题目】将4molA气体和2molB气体充入到1L的密闭容器中,在一定条件下发生如下反应:2A(g)+ B(g)2C(g)。经2s后达到平衡时,测得C的物质的量为1.2 mol。下列说法中正确的是
A.平衡时,A物质的浓度为2.8 mol·L-1
B.平衡时,B的转化率为70%
C.反应后混合气体的总物质的量为5.2mol
D.用C表示平均反应速率为1.2mol·L-1·s-1
【答案】A
【解析】
根据题干信息,将4molA气体和2molB气体充入到IL的密闭容器中,在一定条件下发生如下反应:2A(g)+ B(g)2C(g)。经2s后达到平衡时,测得C的物质的量为1.2 mol,则C转化的物质的量为1.2mol,列三段式有:

据此分析结合选项解答。
A.根据上述分析可知,平衡时A的物质的量为2.8mol,则A的浓度为![]() ,A选项正确;
,A选项正确;
B.平衡时B转化的物质的量为0.6mol,则B的转化率为![]() ,B选项错误;
,B选项错误;
C.反应后混合气体的总物质的量为2.8+1.4+1.2=5.4mol,C选项错误;
D.2s达到平衡时,C消耗的物质的量为1.2mol,则用C表示平均反应速率为 ,D选项错误;
,D选项错误;
答案选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用一定量的铁与足量稀硫酸及足量的氧化铜制单质铜,设计了以下两种方案:
先用铁与稀硫酸反应产生氢气,再用氢气还原氧化铜得到单质铜;
先用稀硫酸溶解氧化铜得到硫酸铜溶液,再与铁发生置换反应得到单质铜。
若按实验原则进行操作,则两者制得单质铜的质量( )
A.一样多
B.①多
C.②多
D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A在一定条件下可以转化为有机物E,其转化关系如下图。已知烃A在标准状况下的密度为116g/L,加热时B与新制氢氧化铜产生砖红色沉淀,E为有浓郁香味、不易溶于水的油状液体。
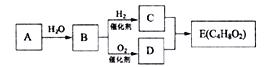
请回答:
(1)B中官能团的结构简式为_________________________。
(2)C+D→E的化学方程式为___________________________________。
(3)下列说法正确的是______
a.C物质与金属钠反应比水与金属钠反应更剧烈
b.有机物C、D、E可用饱和Na2CO3溶液鉴别
c.实验室制备E时,加入浓盐酸做催化剂
d.B能被酸性KMnO4溶液氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法中,正确的是
A.苯及其同系物都能使酸性高锰酸钾溶液褪色
B.苯酚钠溶液中通入CO2生成苯酚,表明苯酚的酸性比碳酸的强
C.乙酸乙酯在酸性或碱性条件下都能发生水解反应
D.可用FeCl3溶液来区分 和
和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉煤灰是燃煤电厂排出的主要固体废物.我国火电厂粉煤灰的主要氧化物组成为![]() 、
、![]() 、CaO等.一种利用粉煤灰制取氧化铝的工艺流程如下:
、CaO等.一种利用粉煤灰制取氧化铝的工艺流程如下:

(1)粉煤灰研磨的目的是____________.
(2)第1次过滤时滤渣的主要成分有____________![]() 填化学式,下同
填化学式,下同![]() 和____________,第3次过滤时滤渣的成分是____________
和____________,第3次过滤时滤渣的成分是____________
(3)在![]() 用硫酸浸取时,铝的浸取率与时间的关系如图1,适宜的浸取时间为____________h;铝的浸取率与
用硫酸浸取时,铝的浸取率与时间的关系如图1,适宜的浸取时间为____________h;铝的浸取率与 的关系如图2所示,从浸取率角度考虑,三种助溶剂
的关系如图2所示,从浸取率角度考虑,三种助溶剂![]() F、KF及
F、KF及![]() 与KF的混合物,在
与KF的混合物,在 相同时,浸取率最高的是____________
相同时,浸取率最高的是____________![]() 填化学式
填化学式![]() ;用含氟的化合物作这种助溶剂的缺点是____________
;用含氟的化合物作这种助溶剂的缺点是____________![]() 举一例
举一例![]() .
.

(4)流程中循环使用的物质有____________和____________![]() 填化学式
填化学式![]()
(5)用盐酸溶解硫酸铝晶体,再通入HCl气体,析出![]() ,该过程能够发生的原因是____________
,该过程能够发生的原因是____________
(6)用粉煤灰制取含铝化合物的主要意义是____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】垃圾是放错地方的资源,工业废料也可以再利用。某化学兴趣小组在实验室中用废弃的含铝、铁、铜的合金制取硫酸铝溶液、硝酸铜晶体和铁红(Fe2O3)。实验方案如下:

(1)写出滤液A中加入足量硫酸后所发生反应的离子方程式:__________________。
(2)已知Fe(OH)3沉淀的pH是3~4,溶液C通过调节pH可以使Fe3+沉淀完全。下列物质中可用作调整溶液C的pH的试剂是________(填序号)。
A.铜粉 | B.氨水 | C.氢氧化铜 | D.碳酸铜 |
(3)常温,若溶液C中金属离子均为1 mol·L-1,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20。控制pH=4,溶液中c(Fe3+)=____________,此时________Cu(OH)2沉淀生成(填“有”或“无”)。
(4)将20 mL Al2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液80 mL混合,反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照下列要求填空
(1)某烷烃的分子量为 72,跟氯气反应生成的一氯代物只有一种,该烷烃的结构简式为_______,名称为________________。
(2)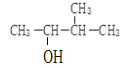 的名称
的名称![]() 系统命名法
系统命名法![]() _________。
_________。
(3)由![]() 的转化过程中,经过的反应类型依次是____________。
的转化过程中,经过的反应类型依次是____________。
(4)乙醇催化氧化生成乙醛,乙醛与环氧乙烷(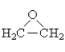 )互为_________。
)互为_________。
(5)已知葡萄糖在乳酸菌作用下可转化为乳酸(C3H6O3)。乳酸在Cu作催化剂时可被氧化成丙酮酸( ),由以上事实推知乳酸的结构简式为_________。由乳酸缩聚反应生成的高分子化合物的结构简式为________________。
),由以上事实推知乳酸的结构简式为_________。由乳酸缩聚反应生成的高分子化合物的结构简式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明一水合氨是弱电解质,甲、乙、丙三位同学利用下面试剂进行实验:
0.10 mol·L-1氨水、NH4Cl晶体、醋酸铵晶体、酚酞试剂、pH试纸、蒸馏水。
(1)常温下,pH=10的氨水中,c(OH-)=___,由水电离出来的浓度为c(OH-)水=_____。
(2)甲用pH试纸测出0.10 mol·L-1氨水的pH为10,据此他认定一水合氨是弱电解质,你认为这一结论______(填“正确”或“不正确”),并说明理由__________________。
(3)乙取出10 mL 0.10 mol·L-1氨水,滴入2滴酚酞试液,显粉红色,原因是(用电离方程式回答):______;再加入CH3COONH4晶体少量,颜色变浅,原因是:__________。你认为这一方法能否证明一水合氨是弱电解质:_____(填“能”或“否”)。
(4)丙取出10 mL 0.10 mol·L-1氨水,用pH试纸测出其pH为a,然后用蒸馏水稀释至1 000 mL,再用pH试纸测出其pH为b,他认为只要a、b满足如下关系__________(用等式或不等式表示)就可以确认一水合氨是弱电解质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和单质溴的工艺流程如图。
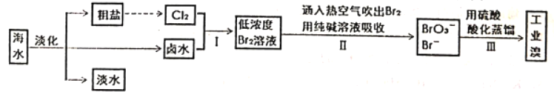
(1)海水淡化的常用方法有_____(请写出一种)
(2)由海水提取的粗盐中含有Ca2+、Mg2+、SO![]() 等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、_____(填化学式),过滤之后,再加入适量盐酸。
等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、_____(填化学式),过滤之后,再加入适量盐酸。
(3)步骤1中获得Br2的离子方程式________
步骤I和步骤II操作的最终目的是_________
(4)配平步骤II操作对应的化学方程式:___Br2+___Na2CO3=__NaBrO3+__ NaBr+___CO2
(5)步骤Ⅲ中用H2SO4酸化处理重新得到Br2,写出该反应的离子方程式_____
若有48g溴单质生成,转移电子的物质的量为____mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com