
【题目】海水是巨大的资源宝库,从海水中提取食盐和单质溴的工艺流程如图。
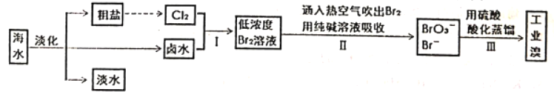
(1)海水淡化的常用方法有_____(请写出一种)
(2)由海水提取的粗盐中含有Ca2+、Mg2+、SO![]() 等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、_____(填化学式),过滤之后,再加入适量盐酸。
等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、_____(填化学式),过滤之后,再加入适量盐酸。
(3)步骤1中获得Br2的离子方程式________
步骤I和步骤II操作的最终目的是_________
(4)配平步骤II操作对应的化学方程式:___Br2+___Na2CO3=__NaBrO3+__ NaBr+___CO2
(5)步骤Ⅲ中用H2SO4酸化处理重新得到Br2,写出该反应的离子方程式_____
若有48g溴单质生成,转移电子的物质的量为____mol
【答案】蒸馏法(或电渗析法或离子交换膜法) Na2CO3 Cl2+2Br-=2C1-+Br2 富集溴元素(或提高溴元素的浓度) 3 3 1 5 3 5Br-+BrO![]() +6H+=3Br2+3H2O 0.5
+6H+=3Br2+3H2O 0.5
【解析】
根据工艺流程图分析可知,通过海水蒸发得到淡水、NaCl、卤水,向卤水中通入电解NaCl产生的氯气,发生反应Cl2+2Br-=2Cl-+Br2,利用热空气吹出溴,用纯碱溶液吸收Br2,发生反应3Br2+3Na2CO3=NaBrO3+5NaBr+3CO2,将溶液酸化蒸馏得到工业溴,据此分析解答问题。
(1)海水淡化常用的方法有蒸馏法、电渗析法、离子交换膜法等;
(2)由海水提取的粗盐中含有Ca2+、Mg2+、SO![]() 等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、Na2CO3,Na2CO3不仅除去Ca2+,还可以除去过量的BaCl2溶液;
等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、Na2CO3,Na2CO3不仅除去Ca2+,还可以除去过量的BaCl2溶液;
(3)步骤Ⅰ中Cl2将Br-氧化为Br2,反应的离子方程式为Cl2+2Br-=2Cl-+Br2,因海水中溴元素含量较少,步骤I中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,目的在于富集溴元素(或提高溴元素的浓度);
(4)反应中,Br2中Br元素的化合价分别由0价升高至+5价,由0价降低至-1价,根据得失电子守恒配平方程式有3Br2+3Na2CO3=NaBrO3+5NaBr+3CO2;
(5)步骤Ⅲ中用H2SO4酸化处理,发生归中反应重新得到Br2,反应的离子方程式为5Br-+BrO![]() +6H+=3Br2+3H2O,反应中每生成3molBr2转移5mol电子,48g溴单质的物质的量为0.3mol,因此,若有48g溴单质生成,转移电子的物质的量为0.5mol。
+6H+=3Br2+3H2O,反应中每生成3molBr2转移5mol电子,48g溴单质的物质的量为0.3mol,因此,若有48g溴单质生成,转移电子的物质的量为0.5mol。


科目:高中化学 来源: 题型:
【题目】将4molA气体和2molB气体充入到1L的密闭容器中,在一定条件下发生如下反应:2A(g)+ B(g)2C(g)。经2s后达到平衡时,测得C的物质的量为1.2 mol。下列说法中正确的是
A.平衡时,A物质的浓度为2.8 mol·L-1
B.平衡时,B的转化率为70%
C.反应后混合气体的总物质的量为5.2mol
D.用C表示平均反应速率为1.2mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe2O3俗称氧化铁红,常用作油漆等着色剂。某实验小组用部分氧化的FeSO4为原料,以萃取剂X(甲基异丁基甲酮)萃取法制取高纯氧化铁并进行铁含量的测定。实验过程中的主要操作步骤如图1。

已知:①在较高的盐酸浓度下,Fe3+能溶解于甲基异丁基甲酮,当盐酸浓度降低时,该化合物解离;
②3DDTCNH4+Fe3+===(DDTC)3Fe↓+3NH4+。
请回答下列问题:
(1)用萃取剂X萃取的步骤中,以下关于萃取分液操作的叙述中,正确的是______________。

A.FeSO4原料中含有的Ca2+、Cu2+等杂质离子几乎都在水相中
B.为提高萃取率和产品产量,实验时分多次萃取并合并萃取液
C.溶液中加入X,转移至分液漏斗中,塞上玻璃塞,如图2用力振摇
D.振摇几次后需打开分液漏斗上口的玻璃塞放气
(2)下列试剂中,可作反萃取的萃取剂Y最佳选择是________。
A.高纯水 B.盐酸 C.稀硫酸 D.酒精
(3)吸油量是反映氧化铁红表面性质的重要指标。吸油量大,说明氧化铁红表面积较大,则用在油漆中会造成油漆假稠,影响质量。不同浓度的两种碱溶液对产物吸油量影响如图3所示,则上述实验过程中选用的碱溶液为_______________(填“NaOH”或“NH3·H2O”),反应的化学方程式为__________。

(4)操作A的步骤包括___________________________________________。
(5)现准确称取4.000 g样品,经酸溶、还原为Fe2+,在容量瓶中配成100 mL溶液,用移液管移取25.00 mL溶液于锥形瓶中,用0.100 0 mol/L的K2Cr2O7溶液进行滴定(还原产物是Cr3+),消耗K2Cr2O7溶液20.80 mL。
①用移液管从容量瓶中吸取25.00 mL溶液后,把溶液转移到锥形瓶中的具体操作为______________
②产品中铁的含量为___________(假设杂质不与K2Cr2O7反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是当今社会发展的三大支柱之一.根据题中提供的信息,请回答下列问题:
I.天然气和甲醇都是一种高效、低耗、污染小的清洁能源。在一定条件下,通过太阳光的作用,形成如图所示的物质循环。

(1)写出甲烷完全燃烧的化学方程式________
(2)如图的物质循环中太阳能最终转化为_________能。
II.新冠疫情防控期间,测温枪发挥了极大的作用。有一种便携式测温枪,里面使用了锌银纽扣式电池,其电极材料分别为Zn和Ag2O,电解质为KOH溶液。工作时电池总反应为:Zn+ Ag2O+H2O=2Ag+ Zn(OH)2
(3)正极的电极反应式为___________
(4)外电路每通过0.4 mole-,负极质量增重了______ g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉常用于合成基础有机物的原料,某实验小组基于淀粉的水解设计了如下合成路线。
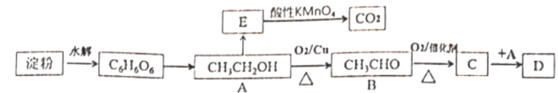
其中:E是最简单的烯烃,D是具有水果香味的物质。
(1) E的结构简式为_____
(2) C中的官能团名称是____
(3)写出A→B的化学方程式___________, 反应类型为________
(4)写出C→D的化学方程式___________,反应类型为_________
(5)要证明淀粉已经彻底水解,选择的检验试剂是_____
(6) E→CO2反应中,MnO![]() 被还原为Mn2+,写出反应的离子方程式_______
被还原为Mn2+,写出反应的离子方程式_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加,由这些元素组成的常见物质的转化关系如下图,其中a、b、d、g为化合物,a为淡黄色固体,c是Z的单质,该单质与沸水缓慢反应,且该单质可制造照明弹;f为固体单质。下列有关说法正确的是

A. 简单离子的半径:Y>Z>X B. 元素的非金属性:W>X
C. 最高价氧化物对应水化物的碱性:Y>Z D. X、Y两种元素组成的化合物只含离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可用于检测CO的某气敏传感器的工作原理如图所示。下列说法不正确的是

A.工作过程中化学能转化为电能
B.工作一段时间后溶液的pH几乎不变
C.电极I上发生反应:CO - 2e- + H2O = CO2 + 2H+
D.电极II上发生反应:O2 + 2H2O + 4e- = 4OH![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下
CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下
A. 加入催化剂,改变了反应的途径,反应的ΔH也随之改变
B. 增大压强,正逆反应的化学反应速率都减小
C. 升高温度, 正反应化学反应速率增大, 逆反应化学反应速率减小
D. 对该反应来说,无论反应进行到何时,混合气体的总物质的量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇燃料电池由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注,其工作示意图如下,其总反应为 2CH3OH+3O2===2CO2+4H2O。下列说法不正确的是( )
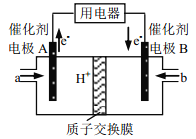
A. 电极 A 是负极,物质 a 为甲醇
B. 电池工作时,电解液中的 H+通过质子交换膜向 B 电极迁移
C. 放电前后电解质溶液的 pH 增大
D. b 物质在电极上发生的电极反应式为: O2+4eˉ+2H2O=4OHˉ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com