
【题目】淀粉常用于合成基础有机物的原料,某实验小组基于淀粉的水解设计了如下合成路线。
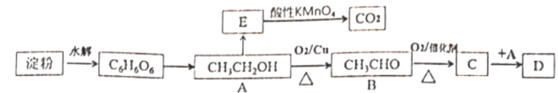
其中:E是最简单的烯烃,D是具有水果香味的物质。
(1) E的结构简式为_____
(2) C中的官能团名称是____
(3)写出A→B的化学方程式___________, 反应类型为________
(4)写出C→D的化学方程式___________,反应类型为_________
(5)要证明淀粉已经彻底水解,选择的检验试剂是_____
(6) E→CO2反应中,MnO![]() 被还原为Mn2+,写出反应的离子方程式_______
被还原为Mn2+,写出反应的离子方程式_______
【答案】CH2=CH2 羧基 2CH3CH2OH + O2![]() 2CH3CHO + 2H2O 氧化反应 CH3COOH +HOCH2CH3
2CH3CHO + 2H2O 氧化反应 CH3COOH +HOCH2CH3![]() CH3COOCH2CH3+ H2O 酯化反应(或取代反应) I2(或碘单质或碘水) 5CH2=CH2+ 12MnO
CH3COOCH2CH3+ H2O 酯化反应(或取代反应) I2(或碘单质或碘水) 5CH2=CH2+ 12MnO![]() + 36H+= 10CO2+ 12Mn2++ 28H2O
+ 36H+= 10CO2+ 12Mn2++ 28H2O
【解析】
根据合成路线分析可知,淀粉水解后生成葡萄糖,葡萄糖在酒化酶的作用下生成乙醇(CH3CH2OH),乙醇催化氧化得到B(CH3CHO),CH3CHO催化氧化得到C(CH3COOH),乙醇得到E,E是最简单的烯烃,则E为乙烯(CH2=CH2),E与酸性高锰酸钾溶液发生氧化还原反应生成CO2,乙醇和乙酸在浓硫酸加热的条件下生成具有水果香味的D(CH3CH2OOCH3),据此分析解答。
(1)根据上述分析可知,E为乙烯,结构简式为CH2=CH2;
(2)C的结构简式为CH3COOH,官能团的名称是羧基;
(3)A→B为乙醇催化氧化得到CH3CHO,反应的化学方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O,反应类型为氧化反应;
2CH3CHO+2H2O,反应类型为氧化反应;
(4)C→D为乙醇和乙酸在浓硫酸加热的条件下生成乙酸乙酯,反应得化学方程式为CH3COOH +HOCH2CH3![]() CH3COOCH2CH3+ H2O,反应类型为酯化反应(或取代反应);
CH3COOCH2CH3+ H2O,反应类型为酯化反应(或取代反应);
(5)要证明淀粉已经彻底水解,可选用I2(或碘单质或碘水)进行检验,若溶液不变蓝,则证明完全水解,反之则未完全水解;
(6)E→CO2反应中,MnO![]() 被还原为Mn2+,反应的离子方程式为5CH2=CH2+12MnO
被还原为Mn2+,反应的离子方程式为5CH2=CH2+12MnO![]() +36H+=10CO2+12Mn2++28H2O。
+36H+=10CO2+12Mn2++28H2O。


科目:高中化学 来源: 题型:
【题目】粉煤灰是燃煤电厂排出的主要固体废物.我国火电厂粉煤灰的主要氧化物组成为![]() 、
、![]() 、CaO等.一种利用粉煤灰制取氧化铝的工艺流程如下:
、CaO等.一种利用粉煤灰制取氧化铝的工艺流程如下:

(1)粉煤灰研磨的目的是____________.
(2)第1次过滤时滤渣的主要成分有____________![]() 填化学式,下同
填化学式,下同![]() 和____________,第3次过滤时滤渣的成分是____________
和____________,第3次过滤时滤渣的成分是____________
(3)在![]() 用硫酸浸取时,铝的浸取率与时间的关系如图1,适宜的浸取时间为____________h;铝的浸取率与
用硫酸浸取时,铝的浸取率与时间的关系如图1,适宜的浸取时间为____________h;铝的浸取率与 的关系如图2所示,从浸取率角度考虑,三种助溶剂
的关系如图2所示,从浸取率角度考虑,三种助溶剂![]() F、KF及
F、KF及![]() 与KF的混合物,在
与KF的混合物,在 相同时,浸取率最高的是____________
相同时,浸取率最高的是____________![]() 填化学式
填化学式![]() ;用含氟的化合物作这种助溶剂的缺点是____________
;用含氟的化合物作这种助溶剂的缺点是____________![]() 举一例
举一例![]() .
.

(4)流程中循环使用的物质有____________和____________![]() 填化学式
填化学式![]()
(5)用盐酸溶解硫酸铝晶体,再通入HCl气体,析出![]() ,该过程能够发生的原因是____________
,该过程能够发生的原因是____________
(6)用粉煤灰制取含铝化合物的主要意义是____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,K=![]() =1.75×10-5,其中K是该温度下CH3COOH的电离平衡常数。下列说法正确的是( )
=1.75×10-5,其中K是该温度下CH3COOH的电离平衡常数。下列说法正确的是( )
A.向该溶液中加入一定量的硫酸,K增大
B.升高温度,K增大
C.向CH3COOH溶液中加入少量水,K增大
D.向CH3COOH溶液中加入少量氢氧化钠溶液,K增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化硼(BCl3)是一种重要的化工原料。实验室制备BCl3的原理B2O3+3C+3Cl2 =2BCl3+3CO,某实验小组利用干燥的氯气和下列装置(装置可重复使用)制备BCl3并验证反应中有CO生成。已知:BCl3的熔点为-107.3℃,沸点为12.5℃,遇水水解生成H3BO3和HCl,请回答下列问题:
(实验Ⅰ)制备BCl3并验证产物CO

(1)该实验装置中合理的连接顺序为G→_____→_____→_____→____→F→D→I。其中装置E的作用是___________________________。
(2)装置J中反应的化学方程式为____________________________________。
(实验Ⅱ)产品中氯含量的测定
①准确称取少许m克产品,置于蒸馏水中完全水解,并配成100mL溶液。
②取10.00mL溶液于锥形瓶中
③加入V1mL浓度为C1 mol/LAgNO3溶液使氯离子完全沉淀;向其中加入少许硝基苯用力摇动。
④以硝酸铁为指示剂,用C2 mol/L KSCN标准溶液滴定过量的AgNO3溶液。发生反应:Ag+ +SCN- =AgSCN↓。
⑤重复步骤②~④二次,达到滴定终点时用去KSCN溶液的平均体积为V2 mL。
已知: Ksp(AgCl)>Ksp(AgSCN) 。
(3)步骤④中达到滴定终点的现象为__________________。
(4)实验过程中加入硝基苯的目的是___________________。
(5)产品中氯元素的质量分数为_________________%。
(6)下列操作,可能引起测得产品中氯含量偏高是__________。
A.步骤③中未加硝基苯
B.步骤①中配制100mL溶液时,定容时俯视刻度线
C.用KSCN溶液滴定剩余AgNO3溶液时,滴定前有气泡,滴定后无气泡
D.滴定剩余AgNO3溶液时,KSCN溶液滴到锥形瓶外面一滴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.水的电离方程式:H2O = H++OH-B.pH=7的溶液一定是中性溶液
C.升高温度,水的电离程度增大D.将稀醋酸加水稀释时,溶液中所有离子浓度均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和单质溴的工艺流程如图。
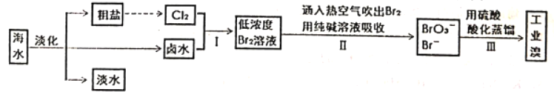
(1)海水淡化的常用方法有_____(请写出一种)
(2)由海水提取的粗盐中含有Ca2+、Mg2+、SO![]() 等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、_____(填化学式),过滤之后,再加入适量盐酸。
等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、_____(填化学式),过滤之后,再加入适量盐酸。
(3)步骤1中获得Br2的离子方程式________
步骤I和步骤II操作的最终目的是_________
(4)配平步骤II操作对应的化学方程式:___Br2+___Na2CO3=__NaBrO3+__ NaBr+___CO2
(5)步骤Ⅲ中用H2SO4酸化处理重新得到Br2,写出该反应的离子方程式_____
若有48g溴单质生成,转移电子的物质的量为____mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g) +2H2(g)![]() CH3OH(g) 。
CH3OH(g) 。
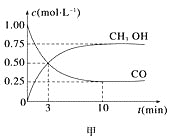

(1)甲图是反应时CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=________molL-11min-1。
(2)乙图表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。反应的焓变是__________(填“△H<0”或“△H>0”)反应,写出该反应的热化学方程式:__________;
(3)该反应平衡常数K的表达式为____,温度升高,平衡常数K________(填“增大”、“不变”或“减小”)。
(4)下列措施能加快反应速率的是__________。
A 升高温度 B 增大容器的容积 C 再充入0.1molCO D 及时分离出CH3OH
(5)下列能说明反应达到平衡状态的是__________。
A 体系压强保持不变 B 混合气体总质量保持不变
C H2和CO的浓度相等 D 每消耗1 mol CO的同时生成1 mol CH3OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,向 2 L密闭容器中加入1 mol NO(g)和1 mol活性炭(C),发生反应:2NO(g)+C(s) ![]() N2(g)+CO2(g) ΔH=-213.5 kJ·mol-1,达到平衡时的数据如下。
N2(g)+CO2(g) ΔH=-213.5 kJ·mol-1,达到平衡时的数据如下。
温度/℃ | n(C)/mol | n(CO2)/mol |
t1 | 0.70 | |
t2 | 0.25 |
下列说法不正确的是( )
A.上述信息可推知:t1<t2
B.t1℃ 时,该反应的平衡常数K=![]()
C.t2℃ 时,若反应达平衡后再缩小容器的容积,c(N2)∶c(NO)不变
D.t1℃ 时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基锂(LiNH2)是一种白色有光泽的结晶或粉末,熔点是390 ℃,沸点是430 ℃,溶于冷水,遇热水则强烈水解。在380~400 ℃时锂与氨气直接反应可制得LiNH2,下面是实验室制备LiNH2时可能用到的装置图,回答下列问题。
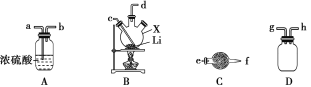
(1)仅从试剂性质角度分析,下列各组试剂不宜用于实验室制备NH3的是__________(填字母)。
A. 浓氨水、CaO B. NH4Cl固体、Ca(OH)2固体
C. 浓氨水 D. NH4NO3固体、NaOH固体
(2)用(1)中合适的试剂制取的NH3按气流方向自左向右,则图中装置的连接顺序为__________(填接口处字母),装置A的作用是__________。
(3)装置C中仪器的名称是___________,盛装的试剂是___________。实验开始后,向X中通入NH3与加热仪器X的先后顺序为___________。
(4)实验室还可用浓氨水与固体NaOH混合制备氨气,但多次实验表明,此方法收集到的NH3量总是比理论值低许多,其最可能的原因是_________。
(5)氨基锂能与热水反应生成LiOH与一种气体,请推测该气体的成分并用实验验证你的结论:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com