
【题目】粉煤灰是燃煤电厂排出的主要固体废物.我国火电厂粉煤灰的主要氧化物组成为![]() 、
、![]() 、CaO等.一种利用粉煤灰制取氧化铝的工艺流程如下:
、CaO等.一种利用粉煤灰制取氧化铝的工艺流程如下:

(1)粉煤灰研磨的目的是____________.
(2)第1次过滤时滤渣的主要成分有____________![]() 填化学式,下同
填化学式,下同![]() 和____________,第3次过滤时滤渣的成分是____________
和____________,第3次过滤时滤渣的成分是____________
(3)在![]() 用硫酸浸取时,铝的浸取率与时间的关系如图1,适宜的浸取时间为____________h;铝的浸取率与
用硫酸浸取时,铝的浸取率与时间的关系如图1,适宜的浸取时间为____________h;铝的浸取率与 的关系如图2所示,从浸取率角度考虑,三种助溶剂
的关系如图2所示,从浸取率角度考虑,三种助溶剂![]() F、KF及
F、KF及![]() 与KF的混合物,在
与KF的混合物,在 相同时,浸取率最高的是____________
相同时,浸取率最高的是____________![]() 填化学式
填化学式![]() ;用含氟的化合物作这种助溶剂的缺点是____________
;用含氟的化合物作这种助溶剂的缺点是____________![]() 举一例
举一例![]() .
.

(4)流程中循环使用的物质有____________和____________![]() 填化学式
填化学式![]()
(5)用盐酸溶解硫酸铝晶体,再通入HCl气体,析出![]() ,该过程能够发生的原因是____________
,该过程能够发生的原因是____________
(6)用粉煤灰制取含铝化合物的主要意义是____________.
【答案】增大反应物的接触面积,提高浸取速率和浸出率 ![]()
![]()
![]() 2
2 ![]() 生产过程中会产生污染环境的HF和
生产过程中会产生污染环境的HF和![]() 等
等 ![]()
![]() 通入氯化氢使
通入氯化氢使![]() 达到饱和,而硫酸铝不饱和 使废弃固体资源化利用
达到饱和,而硫酸铝不饱和 使废弃固体资源化利用
【解析】
粉煤灰的主要氧化物组成为SiO2、Al2O3、CaO等,加入硫酸溶液使Al2O3溶解,CaO通过反应生成CaSO4,CaSO4微溶,大部分CaSO4和SiO2一起成为滤渣,过滤后将滤液冷却结晶得Al2(SO4)3,用盐酸溶解Al2(SO4)3,再通入氯化氢得AlCl36H2O晶体和硫酸溶液,过滤得硫酸溶液可以再循环利用,AlCl36H2O晶体溶解后得氯化铝溶液中通入氨气得氢氧化铝沉淀和氯化铵溶液,氯化铵溶液可以循环利用,氢氧化铝沉淀受热分解生成Al2O3,据此答题。
(1)粉煤灰研磨的目的是增大反应物的接触面积,提高浸取速率和浸出率,故答案为:增大反应物的接触面积,提高浸取速率和浸出率;
(2)通过上面的分析可知,第1次过滤时滤渣的主要成分有SiO2和CaSO4,第3次过滤时滤渣的成分是Al(OH)3,故答案为:SiO2;CaSO4;Al(OH)3;
(3)根据图1可知,2h时铝的浸出率达到最大值,所以适宜的浸取时间为2h,根据图2可知,在![]() 相同时,NH4F助溶剂对铝的浸出率最高,用含氟的化合物作这种助溶剂的缺点是生产过程中会产生污染环境的HF和NH3等,故答案为:2;NH4F;生产过程中会产生污染环境的HF和NH3等;
相同时,NH4F助溶剂对铝的浸出率最高,用含氟的化合物作这种助溶剂的缺点是生产过程中会产生污染环境的HF和NH3等,故答案为:2;NH4F;生产过程中会产生污染环境的HF和NH3等;
(4)根据上面的分析可知,流程中循环使用的物质有H2SO4和NH4Cl,故答案为:H2SO4;NH4Cl;
(5)用盐酸溶解硫酸铝晶体,再通入HCl气体,析出A1C136H2O,该过程能够发生的原因是通入氯化氢使A1C136H2O达到饱和,而硫酸铝不饱和,便于A1C136H2O析出,故答案为:通入氯化氢使A1C136H2O达到饱和,而硫酸铝不饱和;
(6)用粉煤灰制取含铝化合物的主要意义在于使废弃固体资源化利用,故答案为:使废弃固体资源化利用。


科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中: Fe3+、Mg2+、SCN 、Cl –
B.![]() =1×10-12的溶液中:K+、Na+、CO
=1×10-12的溶液中:K+、Na+、CO![]() 、NO
、NO![]()
C.![]() 的溶液中: K+、NH
的溶液中: K+、NH![]() 、MnO
、MnO![]() 、SO
、SO![]()
D.能使甲基橙变红的溶液中: Na+、NH![]() 、SO
、SO![]() 、HCO
、HCO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、油脂、蛋白质都是与生命息息相关的物质,下列有关说法正确的是![]()
![]()
A.葡萄糖和蔗糖是同系物,淀粉和纤维素是同分异构体
B.淀粉、纤维素、油脂、蛋白质都是高分子化合物,都能发生水解反应
C.“春蚕到死丝方尽,蜡炬成灰泪始干”中的“丝”“泪”分别是纤维素和油脂
D.通过灼烧时产生的气味可以鉴别蚕丝和棉纱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了对锂离子电池研发作出卓越贡献的三位科学家。笔记本电脑的电池常用钴酸锂电池,其工作原理如下图所示,总反应为LixC6+Li1-xCoO2 ![]() C6+LiCoO2。下列说法不正确的是
C6+LiCoO2。下列说法不正确的是

A.放电时,负极的电极反应式:LixC6-xe-=xLi++C6
B.放电时,电子由负极经导线、用电器、导线到正极
C.充电时,阳极的电极反应式:LiCoO2-xe-=xLi++Li1-xCoO2
D.充电时,当导线中传递1mol电子,理论上将有1mol Li+向B极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4molA气体和2molB气体充入到1L的密闭容器中,在一定条件下发生如下反应:2A(g)+ B(g)2C(g)。经2s后达到平衡时,测得C的物质的量为1.2 mol。下列说法中正确的是
A.平衡时,A物质的浓度为2.8 mol·L-1
B.平衡时,B的转化率为70%
C.反应后混合气体的总物质的量为5.2mol
D.用C表示平均反应速率为1.2mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醛在氧化铜作催化剂的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示,试管A中装有40%的乙醛水溶液、氧化铜粉末;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见表:
物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
沸点(℃) | 20.8 | 117.9 | 290 | 197.2 | 100 |

请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为_______________。
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在试管A的反应液中;目的是___________;当试管A内的主要反应完成后温度计水银球的位置应在试管A的支管口处;目的是_________。
(3)烧杯B的作用是使试管A内的反应液均匀受热发生反应,使生成的乙酸变成蒸气进入试管C,烧杯B内盛装的液体可以是____。(写出一种即可,在题给物质中找);某同学认为试管C最好置于冰水浴中,其目的是________。
(4)对C中产品进行蒸馏时,蒸馏烧瓶中加入少量___,以除去其中含有的少量水。
A.浓硫酸 B.CaO C.CuSO4溶液 D.无水CaCl2
(5)以下区分乙酸精品和粗品的方法,合理的是_____。
A.加入水观察实验现象
B.加入足量氢氧化钠溶液后,再加入银氨溶液,水浴加热观察实验现象
C.加入碳酸氢钠溶液,振荡后观察实验现象
D.加入少量Na单质,振荡后观察实验现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮类化合物在人类的日常生活中有着重要的作用。
(1)研究表明,在200℃,压强超过200MPa时,不使用催化剂,氨便可以顺利合成。但工业上合成NH3往往在温度500℃压强20~50MPa的条件下进行,已知合成氨为放热反应,试分析原因_____________。
(2)工业上常利用4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)生产硝酸。在同温条件下,向2L的反应容器中充入2mol NH3与2.75molO2,平衡时NH3转化率为50%,则该温度下K=___;保持温度不变,增大压强,则平衡常数_____(填“增大”、“减小”或“不变”);其他条件不变,下列措施一定可以增大氨气转化率的是____。
4NO(g)+6H2O(g)生产硝酸。在同温条件下,向2L的反应容器中充入2mol NH3与2.75molO2,平衡时NH3转化率为50%,则该温度下K=___;保持温度不变,增大压强,则平衡常数_____(填“增大”、“减小”或“不变”);其他条件不变,下列措施一定可以增大氨气转化率的是____。
A.降低氨气浓度 B.增大容器体积 C.降低温度 D.移除水蒸气 E.选择合适的催化剂
(3)已知:A.2NH3(g)+CO2(g)NH2COONH4(l) ΔH=-123kJ/mol
B.NH2COONH4(l)(NH2)2CO(g)+H2O(g) ΔH= +50kJ/mol
①在工业生产中,尿素是由以上A、B两步合成的,则工业上由氨气与二氧化碳合成尿素的热化学反应方程式为:_______________。
②尿素合成过程中通过控制温度、NH3和CO2的物质的量比(氨碳比a)等因素来提高CO2的转化率。如图是在其他因素一定,不同氨碳比条件下CO2平衡转化率与温度的关系图。由图可知当温度一定时,a值越大,CO2转化率越大其原因是______;当a一定时,CO2平衡转化率呈现先增大后减小的趋势,其原因为_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉常用于合成基础有机物的原料,某实验小组基于淀粉的水解设计了如下合成路线。
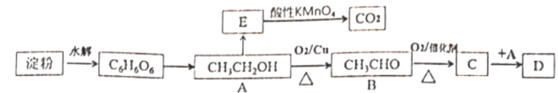
其中:E是最简单的烯烃,D是具有水果香味的物质。
(1) E的结构简式为_____
(2) C中的官能团名称是____
(3)写出A→B的化学方程式___________, 反应类型为________
(4)写出C→D的化学方程式___________,反应类型为_________
(5)要证明淀粉已经彻底水解,选择的检验试剂是_____
(6) E→CO2反应中,MnO![]() 被还原为Mn2+,写出反应的离子方程式_______
被还原为Mn2+,写出反应的离子方程式_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com