
【题目】乙醛在氧化铜作催化剂的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示,试管A中装有40%的乙醛水溶液、氧化铜粉末;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见表:
物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
沸点(℃) | 20.8 | 117.9 | 290 | 197.2 | 100 |

请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为_______________。
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在试管A的反应液中;目的是___________;当试管A内的主要反应完成后温度计水银球的位置应在试管A的支管口处;目的是_________。
(3)烧杯B的作用是使试管A内的反应液均匀受热发生反应,使生成的乙酸变成蒸气进入试管C,烧杯B内盛装的液体可以是____。(写出一种即可,在题给物质中找);某同学认为试管C最好置于冰水浴中,其目的是________。
(4)对C中产品进行蒸馏时,蒸馏烧瓶中加入少量___,以除去其中含有的少量水。
A.浓硫酸 B.CaO C.CuSO4溶液 D.无水CaCl2
(5)以下区分乙酸精品和粗品的方法,合理的是_____。
A.加入水观察实验现象
B.加入足量氢氧化钠溶液后,再加入银氨溶液,水浴加热观察实验现象
C.加入碳酸氢钠溶液,振荡后观察实验现象
D.加入少量Na单质,振荡后观察实验现象
【答案】2CH3CHO+O2![]() 2CH3COOH 测量反应溶液的温度 收集含乙酸的馏分 乙二醇(或甘油) 有利于乙酸的冷凝收集 D B
2CH3COOH 测量反应溶液的温度 收集含乙酸的馏分 乙二醇(或甘油) 有利于乙酸的冷凝收集 D B
【解析】
本实验的目的是催化氧化乙醛制取乙酸,装置A装乙醛在氧化铜作催化剂、加热至60℃~80℃的条件下生成乙酸,根据实验装置图可知本实验中的加热方式液体加热,根据题意可知反应完成后,需要加热使乙酸变成水蒸气进入收集装置,所以选用的液体的沸点应高于乙酸的沸点,为了更好的收集乙酸,可以收集装置置于冰水浴中。
(1)乙醛与氧气发生氧化反应生成乙酸,反应方程式为:2CH3CHO+O2![]() 2CH3COOH;
2CH3COOH;
(2)实验开始时温度计应测量反应溶液的温度,控制反应温度为60℃~80℃,所以实验开始时温度计水银球的位置应在试管A的反应液中;由蒸馏原理可知,温度计测量的是蒸气的温度,所以温度计水银球的位置应在试管A的支管口处,目的是收集含乙酸的馏分;
(3)用液体加热,能使试管受热均匀,乙酸的沸点为117.9℃,要想通过蒸馏的方法得到乙酸,B内盛装的液体的沸点应大于117.9℃,由表可知烧杯B内盛装的液体可以是乙二醇或甘油;试管C是用来接收乙酸蒸气的,冰水浴能使乙酸蒸气冷凝,有利于乙酸的收集;
(4)除去乙酸中的水,要加能吸收水,而且不与乙酸反应的物质,CaO与乙酸反应、浓硫酸和硫酸铜溶液为液体不能与乙酸分离,所以要加无水氯化钙,故答案为:D;
(5)A.粗品中可能含有乙醛,乙醛也溶于水,所以加入水不能区分,故A错误;
B.加入足量氢氧化钠溶液后,再加入银氨溶液,水浴加热观察实验现象,有银镜生成的,说明为粗品,故B正确;
C.乙酸精品和粗品都含有乙酸,都能碳酸氢钠反应生成气体,不能区别二者,故C错误;
D.乙酸精品和粗品都和钠反应生成氢气,不能区别二者,故D错误;
故答案为:B。


科目:高中化学 来源: 题型:
【题目】常温下,等体积的氨水和KOH两种溶液,其![]() ,下列说法正确的是
,下列说法正确的是![]()
A.![]() 的浓度小于KOH
的浓度小于KOH
B.分别向两溶液中加入盐酸完全中和后,溶液中水的电离程度前者大于后者
C.两溶液加水稀释过程中 、
、 均增大
均增大
D.分别加水稀释相同倍数后,溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由丙烯经下列反应可得到F、G两种高分子化合物,它们都是常用的塑料。
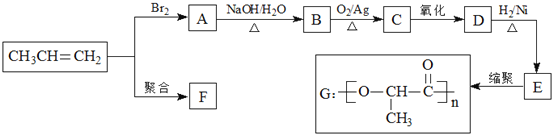
(1)B的官能团的名称 ______。
(2)B转化为C的化学方程式是______。
(3)在一定条件下,两分子E能脱去两分子水形成一种六元环化合物,该化合物的结构简式是 ______。
(4)E有多种同分异构体,其中一种能发生银镜反应,1mol该种同分异构体与足量的金属钠反应产生1molH2,则该种同分异构体的结构简式为 ______。
(5)写出由乙烯制聚乙二酸乙二酯的合成路线(无机试剂可任选) ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉煤灰是燃煤电厂排出的主要固体废物.我国火电厂粉煤灰的主要氧化物组成为![]() 、
、![]() 、CaO等.一种利用粉煤灰制取氧化铝的工艺流程如下:
、CaO等.一种利用粉煤灰制取氧化铝的工艺流程如下:

(1)粉煤灰研磨的目的是____________.
(2)第1次过滤时滤渣的主要成分有____________![]() 填化学式,下同
填化学式,下同![]() 和____________,第3次过滤时滤渣的成分是____________
和____________,第3次过滤时滤渣的成分是____________
(3)在![]() 用硫酸浸取时,铝的浸取率与时间的关系如图1,适宜的浸取时间为____________h;铝的浸取率与
用硫酸浸取时,铝的浸取率与时间的关系如图1,适宜的浸取时间为____________h;铝的浸取率与 的关系如图2所示,从浸取率角度考虑,三种助溶剂
的关系如图2所示,从浸取率角度考虑,三种助溶剂![]() F、KF及
F、KF及![]() 与KF的混合物,在
与KF的混合物,在 相同时,浸取率最高的是____________
相同时,浸取率最高的是____________![]() 填化学式
填化学式![]() ;用含氟的化合物作这种助溶剂的缺点是____________
;用含氟的化合物作这种助溶剂的缺点是____________![]() 举一例
举一例![]() .
.

(4)流程中循环使用的物质有____________和____________![]() 填化学式
填化学式![]()
(5)用盐酸溶解硫酸铝晶体,再通入HCl气体,析出![]() ,该过程能够发生的原因是____________
,该过程能够发生的原因是____________
(6)用粉煤灰制取含铝化合物的主要意义是____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 年,比利时人索尔维
年,比利时人索尔维![]()
![]() 用氨碱法生产碳酸钠.反应原理如下:
用氨碱法生产碳酸钠.反应原理如下:

![]() 时一些物质在水中的溶解度
时一些物质在水中的溶解度![]()
NaCl |
|
|
|
|
|
|
|
|
|

(1)氨碱法生成纯碱的原料是____________,可循环利用的物质有____________.
(2)饱和NaCl溶液通![]() 和
和![]() 能生成
能生成![]() 的原因有:____________/span>.
的原因有:____________/span>.
Ⅲ![]() 我国化工专家侯德榜研究出联合制碱法,其反应原理和氨碱法类似,但将制氨和制碱联合,提高了原料利用率.
我国化工专家侯德榜研究出联合制碱法,其反应原理和氨碱法类似,但将制氨和制碱联合,提高了原料利用率.
(3)生产中需向分离出![]() 后所得的溶液中加入NaCl固体并通入
后所得的溶液中加入NaCl固体并通入![]() ,在____________
,在____________![]() 填温度范围
填温度范围![]() 下析出____________
下析出____________![]() 填化学式
填化学式![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照下列要求填空
(1)某烷烃的分子量为 72,跟氯气反应生成的一氯代物只有一种,该烷烃的结构简式为_______,名称为________________。
(2)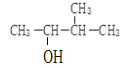 的名称
的名称![]() 系统命名法
系统命名法![]() _________。
_________。
(3)由![]() 的转化过程中,经过的反应类型依次是____________。
的转化过程中,经过的反应类型依次是____________。
(4)乙醇催化氧化生成乙醛,乙醛与环氧乙烷(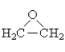 )互为_________。
)互为_________。
(5)已知葡萄糖在乳酸菌作用下可转化为乳酸(C3H6O3)。乳酸在Cu作催化剂时可被氧化成丙酮酸( ),由以上事实推知乳酸的结构简式为_________。由乳酸缩聚反应生成的高分子化合物的结构简式为________________。
),由以上事实推知乳酸的结构简式为_________。由乳酸缩聚反应生成的高分子化合物的结构简式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】增塑剂(又叫塑化剂)是一种增加塑料柔韧性、弹性等的添加剂,不能用于食品、酒类等行业。DBP(邻苯二甲酸二丁酯)是增塑剂的一种,可由下列路线合成:

已知以下信息:
①
![]()

②R2CHO+R2CH2CHO![]()
![]()
(-R1、-R2表示氢原子或烃基)
(1)A的结构简式 ______,D→E的反应类型 __________。
(2)DBP的分子式为 __________,D的结构简式是 ___________。
(3)由B和E以物质的量比1:2合成DBP的化学方程式: ________。
(4)写出同时符合下列条件的B的所有同分异构体结构简式 __________。
①能和NaHCO3溶液反应生成CO2;②能发生银镜反应
③能使FeCl3溶液发生显色反应;④苯环上含碳基团处于对位
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,K=![]() =1.75×10-5,其中K是该温度下CH3COOH的电离平衡常数。下列说法正确的是( )
=1.75×10-5,其中K是该温度下CH3COOH的电离平衡常数。下列说法正确的是( )
A.向该溶液中加入一定量的硫酸,K增大
B.升高温度,K增大
C.向CH3COOH溶液中加入少量水,K增大
D.向CH3COOH溶液中加入少量氢氧化钠溶液,K增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g) +2H2(g)![]() CH3OH(g) 。
CH3OH(g) 。
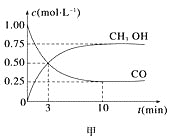

(1)甲图是反应时CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=________molL-11min-1。
(2)乙图表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。反应的焓变是__________(填“△H<0”或“△H>0”)反应,写出该反应的热化学方程式:__________;
(3)该反应平衡常数K的表达式为____,温度升高,平衡常数K________(填“增大”、“不变”或“减小”)。
(4)下列措施能加快反应速率的是__________。
A 升高温度 B 增大容器的容积 C 再充入0.1molCO D 及时分离出CH3OH
(5)下列能说明反应达到平衡状态的是__________。
A 体系压强保持不变 B 混合气体总质量保持不变
C H2和CO的浓度相等 D 每消耗1 mol CO的同时生成1 mol CH3OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com