
【题目】能源是当今社会发展的三大支柱之一.根据题中提供的信息,请回答下列问题:
I.天然气和甲醇都是一种高效、低耗、污染小的清洁能源。在一定条件下,通过太阳光的作用,形成如图所示的物质循环。

(1)写出甲烷完全燃烧的化学方程式________
(2)如图的物质循环中太阳能最终转化为_________能。
II.新冠疫情防控期间,测温枪发挥了极大的作用。有一种便携式测温枪,里面使用了锌银纽扣式电池,其电极材料分别为Zn和Ag2O,电解质为KOH溶液。工作时电池总反应为:Zn+ Ag2O+H2O=2Ag+ Zn(OH)2
(3)正极的电极反应式为___________
(4)外电路每通过0.4 mole-,负极质量增重了______ g
【答案】CH4+2O2![]() CO2+2H2O 热 Ag2O+2e-+H2O = 2Ag+ 2OH- 6.8
CO2+2H2O 热 Ag2O+2e-+H2O = 2Ag+ 2OH- 6.8
【解析】
Ⅰ(1)甲烷完全燃烧生成CO2和H2O,燃烧的化学方程式为CH4+2O2![]() CO2+2H2O;
CO2+2H2O;
(2)根据图示,CO2和H2O,吸收太阳能,最终转化为CH4、CH3OH等燃烧,燃烧燃烧,释放出燃烧热;因此太阳能最终转化为热能;
Ⅱ(3)原电池的正极,得到电子,发生还原反应;根据总反应,可知Ag2O得到电子,转化为Ag,则正极的电极反应式为Ag2O+2e-+H2O=2Ag+2OH-;
(4)Zn作负极,失去电子转化为Zn(OH)2,负极增加的质量为OH-的质量。负极的电极方程式为Zn-2e-+2OH-=Zn(OH)2,外电路每通过0.4mole-,则负极Zn就会结合0.4molOH-转化为Zn(OH)2,则增加的质量为0.4molOH-的质量,为17g·mol-1×0.4mol=6.8g。


科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法中,正确的是
A.苯及其同系物都能使酸性高锰酸钾溶液褪色
B.苯酚钠溶液中通入CO2生成苯酚,表明苯酚的酸性比碳酸的强
C.乙酸乙酯在酸性或碱性条件下都能发生水解反应
D.可用FeCl3溶液来区分 和
和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明一水合氨是弱电解质,甲、乙、丙三位同学利用下面试剂进行实验:
0.10 mol·L-1氨水、NH4Cl晶体、醋酸铵晶体、酚酞试剂、pH试纸、蒸馏水。
(1)常温下,pH=10的氨水中,c(OH-)=___,由水电离出来的浓度为c(OH-)水=_____。
(2)甲用pH试纸测出0.10 mol·L-1氨水的pH为10,据此他认定一水合氨是弱电解质,你认为这一结论______(填“正确”或“不正确”),并说明理由__________________。
(3)乙取出10 mL 0.10 mol·L-1氨水,滴入2滴酚酞试液,显粉红色,原因是(用电离方程式回答):______;再加入CH3COONH4晶体少量,颜色变浅,原因是:__________。你认为这一方法能否证明一水合氨是弱电解质:_____(填“能”或“否”)。
(4)丙取出10 mL 0.10 mol·L-1氨水,用pH试纸测出其pH为a,然后用蒸馏水稀释至1 000 mL,再用pH试纸测出其pH为b,他认为只要a、b满足如下关系__________(用等式或不等式表示)就可以确认一水合氨是弱电解质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E,在元素周期表中的大概的相对位置如图所示,A与B形成能使湿润的红色石蕊试纸变蓝的气体,D与C形成离子化合物D2C.请回答下列问题:

(1)写出B元素的名称____
(2) E在元素周期表中的位置为______
(3)写出A与B形成能使湿润的红色石蕊试纸变蓝的气体的电子式_____
(4) D的最高价氧化物对应水化物中存在的化学键是_____
(5)写出D2C2与A2C反应的化学方程式_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化硼(BCl3)是一种重要的化工原料。实验室制备BCl3的原理B2O3+3C+3Cl2 =2BCl3+3CO,某实验小组利用干燥的氯气和下列装置(装置可重复使用)制备BCl3并验证反应中有CO生成。已知:BCl3的熔点为-107.3℃,沸点为12.5℃,遇水水解生成H3BO3和HCl,请回答下列问题:
(实验Ⅰ)制备BCl3并验证产物CO

(1)该实验装置中合理的连接顺序为G→_____→_____→_____→____→F→D→I。其中装置E的作用是___________________________。
(2)装置J中反应的化学方程式为____________________________________。
(实验Ⅱ)产品中氯含量的测定
①准确称取少许m克产品,置于蒸馏水中完全水解,并配成100mL溶液。
②取10.00mL溶液于锥形瓶中
③加入V1mL浓度为C1 mol/LAgNO3溶液使氯离子完全沉淀;向其中加入少许硝基苯用力摇动。
④以硝酸铁为指示剂,用C2 mol/L KSCN标准溶液滴定过量的AgNO3溶液。发生反应:Ag+ +SCN- =AgSCN↓。
⑤重复步骤②~④二次,达到滴定终点时用去KSCN溶液的平均体积为V2 mL。
已知: Ksp(AgCl)>Ksp(AgSCN) 。
(3)步骤④中达到滴定终点的现象为__________________。
(4)实验过程中加入硝基苯的目的是___________________。
(5)产品中氯元素的质量分数为_________________%。
(6)下列操作,可能引起测得产品中氯含量偏高是__________。
A.步骤③中未加硝基苯
B.步骤①中配制100mL溶液时,定容时俯视刻度线
C.用KSCN溶液滴定剩余AgNO3溶液时,滴定前有气泡,滴定后无气泡
D.滴定剩余AgNO3溶液时,KSCN溶液滴到锥形瓶外面一滴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体混合物X可能含有NaNO2、Na2SiO3、FeCl3、KAlO2中的一种或几种物质,某同学对该固体进行了如下实验:
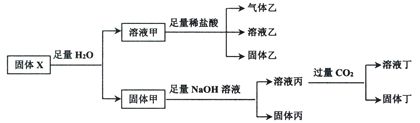
下列判断正确的是
A.溶液甲中一定含有NaNO2、Na2SiO3,可能含有FeCl3、KAlO2
B.原固体混合物X中一定有KAlO2
C.固体乙、固体丁一定是纯净物
D.将溶液乙和溶液丁混合一定有无色气体生成,可能有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和单质溴的工艺流程如图。
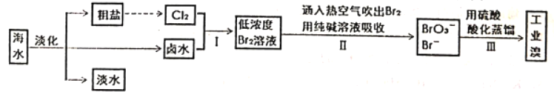
(1)海水淡化的常用方法有_____(请写出一种)
(2)由海水提取的粗盐中含有Ca2+、Mg2+、SO![]() 等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、_____(填化学式),过滤之后,再加入适量盐酸。
等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、_____(填化学式),过滤之后,再加入适量盐酸。
(3)步骤1中获得Br2的离子方程式________
步骤I和步骤II操作的最终目的是_________
(4)配平步骤II操作对应的化学方程式:___Br2+___Na2CO3=__NaBrO3+__ NaBr+___CO2
(5)步骤Ⅲ中用H2SO4酸化处理重新得到Br2,写出该反应的离子方程式_____
若有48g溴单质生成,转移电子的物质的量为____mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组探究![]() 与
与![]() 溶液的反应,所用装置如下图所示
溶液的反应,所用装置如下图所示![]() 夹持仪器已略去
夹持仪器已略去![]() 。
。
![]() 实验室配制和保存
实验室配制和保存![]() 溶液应滴加少许______于试剂瓶中。
溶液应滴加少许______于试剂瓶中。
![]() 实验过程中需要配制
实验过程中需要配制![]()
![]() 溶液,所需要的玻璃仪器有:烧杯、量筒、玻璃棒、胶头滴管、______。
溶液,所需要的玻璃仪器有:烧杯、量筒、玻璃棒、胶头滴管、______。
![]() 该小组同学向5mL
该小组同学向5mL![]()
![]() 溶液中通入足量的
溶液中通入足量的![]() ,溶液最终呈浅绿色,再打开分液漏斗活塞,逐滴加入NaOH稀溶液,则试管B中产生的实验现象是______。
,溶液最终呈浅绿色,再打开分液漏斗活塞,逐滴加入NaOH稀溶液,则试管B中产生的实验现象是______。
![]() 该小组同学在
该小组同学在![]() 中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象,最终溶液呈浅绿色。
中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象,最终溶液呈浅绿色。
(查阅资料)![]() 离子在溶液中呈红棕色且具有较强的还原性,能被
离子在溶液中呈红棕色且具有较强的还原性,能被![]() 氧化为
氧化为![]() 与
与![]() 溶液反应生成红棕色
溶液反应生成红棕色![]() 离子的离子方程式是______;
离子的离子方程式是______;![]() 与
与![]() 在溶液中反应的离子方程式是______。
在溶液中反应的离子方程式是______。
![]() 为了安全起见,还可以在A、B装置之间加一个______装置。
为了安全起见,还可以在A、B装置之间加一个______装置。

![]() 若实验中用5mL
若实验中用5mL![]() 与适量Cu片充分反应,实验结束后,测得产生
与适量Cu片充分反应,实验结束后,测得产生![]() 的体积在标准状况下为672mL,向已冷却的A试管溶液中加入
的体积在标准状况下为672mL,向已冷却的A试管溶液中加入![]() 的NaOH溶液30mL时,恰好使
的NaOH溶液30mL时,恰好使![]() 完全沉淀。则所用浓
完全沉淀。则所用浓![]() 浓度为______。
浓度为______。![]() 忽略过程中溶液的体积变化
忽略过程中溶液的体积变化![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol/L盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示,下列判断正确的是( )
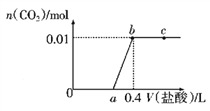
A. a点时溶液中存在c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
B. 0~a段溶液中水电离出的OH-浓度先增大后减小
C. a=0.2
D. ab段发生反应的离子方程式为CO32-+2H+=H2O+CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com