
【题目】环丙基乙烯(VCP)结构为![]() ,下列关于该物质说法不正确的是
,下列关于该物质说法不正确的是
A.环丙基乙烯属于烃类
B.该物质能发生取代反应、加成反应、聚合反应、氧化反应
C.环丙基乙烯与环戊二烯 (![]() )互为同分异构体
)互为同分异构体
D.环丙基乙烯的一氯代物有4种
 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列说法正确的是![]()
A.分别中和pH相同的等体积的盐酸和醋酸溶液,消耗等量的NaOH
B.![]() 的
的![]() 溶液加水稀释
溶液加水稀释![]() 倍后,
倍后,![]()
C.pH相等的![]() 、NaOH溶液中,水的电离程度相同
、NaOH溶液中,水的电离程度相同
D.![]() 溶液中:
溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①![]() 是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2
是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH;③已知乳酸E的结构简式为
2CH3COOH;③已知乳酸E的结构简式为![]() 。现以A为主要原料合成乙酸乙酯,其合成路线如图所示:
。现以A为主要原料合成乙酸乙酯,其合成路线如图所示:
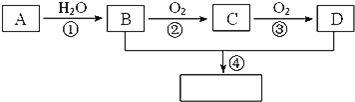
回答下列问题:
(1)A的电子式 ______,A结构简式______。
(2)B的结构简式 ______,D的结构简式 ______。
(3)B和D的分子中分别含 ______和______两种官能团(写名称)。
(4)写出下列反应的化学方程式并注明反应类型:
A→B ______; ______。
B→C______; ______。
B和D反应生成乙酸乙酯的反应并注明反应类型:______; ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关文献记载中涉及的化学知识表述不正确的是( )
A.“以曾青涂铁,铁赤色如铜”说明我国古代就掌握了“湿法冶金”技术
B.“墙塌压糖,去土而糖白”中的脱色过程发生了化学变化
C.“丹砂烧之成水银,积变又还成丹砂”讲的是单质与化合物之间的互变
D.《本草纲目》中记载:“烧酒非古法也,……,用浓酒和糟入甑,蒸令气上,用器承取滴露。”涉及的操作方法是蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。下列说法正确的是( )
2SO3(g) ΔH<0。下列说法正确的是( )
A.达到平衡后,升高温度平衡正向移动B.达到平衡时:v(O2)=2v(SO2)
C.达到平衡后,降低温度O2的浓度将减小D.升高温度,正反应速率增加,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛矿工业中的酸性废水富含Ti、Fe等元素,其综合利用如图![]() 已知:
已知:![]() 易水解,只能存在于强酸性溶液中
易水解,只能存在于强酸性溶液中![]() :
:

(1)富含![]() 溶液中加入
溶液中加入![]() 粉末能得到固体
粉末能得到固体![]() ,其原理是______。
,其原理是______。
(2)制取![]() 发生的化学方程式为______;反应温度一般需控制在
发生的化学方程式为______;反应温度一般需控制在![]() 以下,其目的是______。
以下,其目的是______。
(3)已知![]() 。制取
。制取![]() 时,
时,![]() 达到溶解平衡时,若室温下测得溶液的pH为
达到溶解平衡时,若室温下测得溶液的pH为![]() ,
,![]() 。试判断所得的
。试判断所得的![]() 中______
中______![]() 填“有”或“没有”
填“有”或“没有”![]() ;煅烧中,为了得到较为纯净的
;煅烧中,为了得到较为纯净的![]() ,除了适当的温度外,还需要采取的措施是______。
,除了适当的温度外,还需要采取的措施是______。
(4)为了控制![]() 用量需要测定固体中
用量需要测定固体中![]() 的含量。称1g固体样品,用30mL蒸馏水溶解并加入
的含量。称1g固体样品,用30mL蒸馏水溶解并加入![]() 溶液和
溶液和![]() 溶液,再用
溶液,再用![]() 标准溶液滴定到溶液刚好变成粉红色,停止滴定,消耗标准溶液VmL。反应中涉及的重要化学方程式有:
标准溶液滴定到溶液刚好变成粉红色,停止滴定,消耗标准溶液VmL。反应中涉及的重要化学方程式有:
![]() 紫红
紫红![]() 粉红
粉红![]()
![]() 黄
黄![]() 无色
无色![]()
①![]() 的作用______。②样品中
的作用______。②样品中![]() 的含量为______
的含量为______![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。发生的反应如下:

CH3CH2CH2CH2OH![]() CH3CH2CH2CHO ,反应物和产物的相关数据列表如下:
CH3CH2CH2CHO ,反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.810 9 | 微溶 |
正丁醛 | 75.7 | 0.801 7 | 微溶 |
实验步骤如下:将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,与5 mL浓硫酸形成混合溶液,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95 ℃,在E中收集90 ℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77 ℃馏分,产量2.0 g。
回答下列问题:
(1)实验中,Na2Cr2O7溶液和浓硫酸添加的顺序为___________________________。
(2)加入沸石的作用是________________________________________________。
若加热后发现未加沸石,应采取的正确方法是______________________________。
(3)上述装置图中,D仪器的名称是________,E仪器的名称是________。
(4)分液漏斗使用前必须进行的操作是________。
(5)将正丁醛粗产品置于分液漏斗中分水时,正丁醛在_______________层(填“上”或“下”)。
(6)反应温度应保持在90~95 ℃,其原因是__________________________________、__________________________________________________。
(7)本实验中,正丁醛的产率为________%(结果保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含MgCl2、AlCl3均为nmol的混合溶液,向其中滴NaOH溶液至过量。加入NaOH的物质的量与生成沉淀的物质的量的关系正确的是(离子(或物质)沉淀pH见表)
离子 | Mg2+ | Al3+ | 物质 | Al(OH)3 |
开始沉淀时的pH | 8.93 | 3.56 | 开始溶解时的pH | 8.04 |
完全沉淀时的pH | 10.92 | 4.89 | 完全溶解时的pH | 12.04 |
A. 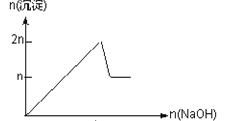
B. 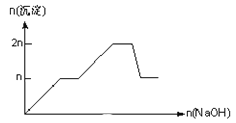
C. 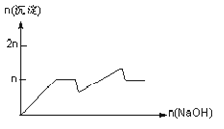
D. 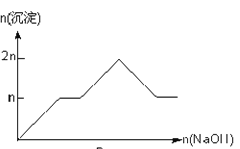
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保险粉(Na2S2O4)广泛应用于造纸、印染、环保、医药等行业。该物质具有强还原性,在空气中易被氧化,受热易分解,在碱性条件下比较稳定,易溶于水、不溶于乙醇。保险粉可以通过 NaHSO3与NaBH4反应制取。请按要求回答下列问题:
I.NaHSO3溶液的制备
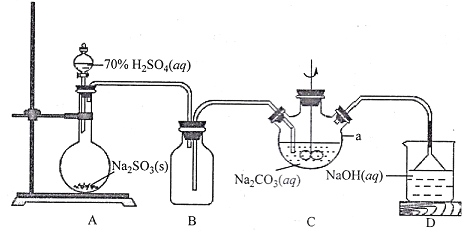
(1)上图仪器a的名称___________;装置C中反应后溶液pH=4.1,则发生反应的化学方程式为___________。
II.保险粉的制备
打开下图(部分装置已省略)中活塞K1通入氮气,一段时间后,关闭K1,打开恒压滴液漏斗活塞向装置E中滴入碱性NaBH4溶液,在30-40℃下充分反应。向反应后的溶液中加入乙醇,经冷却结晶、过滤得到Na2S2O4·2H2O晶体,再用乙醇洗涤、真空烘干脱去晶体结晶水得到保险粉。
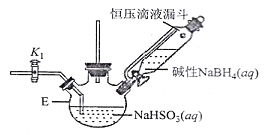
(2)反应产物中有NaBO2,无气体。写出E中发生反应的化学方程式___________。
(3)通入氮气的作用是______________________。
(4)使用乙醇洗涤Na2S2O4·2H2O晶体的优点:______________________。
(5)对装置E的加热方式最好采用______________________。
Ⅲ.保险粉的纯度测定
(6)称取2.0g Na2S2O4样品溶于冷水配成200mL溶液,取出25.00mL该溶液于锥形瓶中,用0.10mol/L碱性K3[Fe(CN)6]标准溶液滴定,原理为:4[Fe(CN)6]3-+2S2O42-+8OH-=4[Fe(CN)6]4-+4SO32-+4H2O,用亚甲基蓝为指示剂,达到滴定终点时消耗标准溶液24.00mL,则样品中Na2S2O4的质量分数为___________(杂质不参与反应)(计算结果精确至0.1%)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com