
【题目】保险粉(Na2S2O4)广泛应用于造纸、印染、环保、医药等行业。该物质具有强还原性,在空气中易被氧化,受热易分解,在碱性条件下比较稳定,易溶于水、不溶于乙醇。保险粉可以通过 NaHSO3与NaBH4反应制取。请按要求回答下列问题:
I.NaHSO3溶液的制备
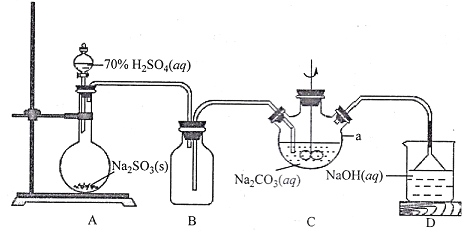
(1)上图仪器a的名称___________;装置C中反应后溶液pH=4.1,则发生反应的化学方程式为___________。
II.保险粉的制备
打开下图(部分装置已省略)中活塞K1通入氮气,一段时间后,关闭K1,打开恒压滴液漏斗活塞向装置E中滴入碱性NaBH4溶液,在30-40℃下充分反应。向反应后的溶液中加入乙醇,经冷却结晶、过滤得到Na2S2O4·2H2O晶体,再用乙醇洗涤、真空烘干脱去晶体结晶水得到保险粉。
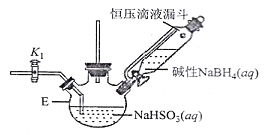
(2)反应产物中有NaBO2,无气体。写出E中发生反应的化学方程式___________。
(3)通入氮气的作用是______________________。
(4)使用乙醇洗涤Na2S2O4·2H2O晶体的优点:______________________。
(5)对装置E的加热方式最好采用______________________。
Ⅲ.保险粉的纯度测定
(6)称取2.0g Na2S2O4样品溶于冷水配成200mL溶液,取出25.00mL该溶液于锥形瓶中,用0.10mol/L碱性K3[Fe(CN)6]标准溶液滴定,原理为:4[Fe(CN)6]3-+2S2O42-+8OH-=4[Fe(CN)6]4-+4SO32-+4H2O,用亚甲基蓝为指示剂,达到滴定终点时消耗标准溶液24.00mL,则样品中Na2S2O4的质量分数为___________(杂质不参与反应)(计算结果精确至0.1%)。
【答案】三颈烧瓶 2SO2+Na2CO3+H2O=2NaHSO3+CO2 NaBH4+8NaHSO3![]() NaBO2+4Na2S2O4+6H2O 将装置E中空气赶出,防止NaHSO3 (或Na2S2O4)被氧化 减少保险粉的溶解损失(并有利于干燥) 水浴加热 83.5%
NaBO2+4Na2S2O4+6H2O 将装置E中空气赶出,防止NaHSO3 (或Na2S2O4)被氧化 减少保险粉的溶解损失(并有利于干燥) 水浴加热 83.5%
【解析】
I.在烧瓶中H2SO4与Na2SO3发生复分解反应制取SO2气体,产生的气体通过安全瓶后进入到三颈烧瓶中,与NaOH、Na2CO3溶液发生反应制取得到NaHSO3;SO2是大气污染物,在排放前要用NaOH溶液进行尾气处理;
II.将上述制得的NaHSO3放入三颈烧瓶E中,与恒压滴液漏斗中加入的NaBH4发生反应产生NaBO2、Na2S2O4及水,为防止空气将NaHSO3 或制取得到Na2S2O4氧化,在反应前先向装置中通入N2或惰性气体;为使反应温度在30-40℃下进行,可利用水浴加热的温度便于控制及受热均匀的特点,进行水浴加热;为减小洗涤Na2S2O4·2H2O晶体时造成的损失,可用无水乙醇进行洗涤;
III. 用亚甲基蓝为指示剂,根据反应4[Fe(CN)6]3-+2S2O42-+8OH-=4[Fe(CN)6]4-+4SO32-+4H2O中K3[Fe(CN)6]与Na2S2O4的物质的量关系,计算出Na2S2O4的质量,再根据物质的含量计算方法得到样品中Na2S2O4的质量分数。
(1)根据上图仪器a的结构可知a仪器的名称是三颈烧瓶;A装置产生的SO2气体在C中与容器中的NaOH、Na2CO3发生反应,反应后溶液pH=4.1<7,溶液显酸性,说明得到的是NaHSO3,则发生反应的化学方程式为2SO2+Na2CO3+H2O=2NaHSO3+CO2;
(2)在装置E中,NaHSO3与由恒压滴液漏斗中加入的NaBH4发生反应产生NaBO2、Na2S2O4及水,根据电子守恒、原子守恒,可得E中发生反应的化学方程式为:NaBH4+8NaHSO3 ![]() NaBO2+4Na2S2O4+6H2O;
NaBO2+4Na2S2O4+6H2O;
(3)在装置内的空气中含有的氧气具有氧化性,容易将反应物NaHSO3氧化,也容易将反应产生的Na2S2O4氧化,所以为防止发生氧化反应,要先通入N2,将装置内的空气排出,因此通入氮气的作用是将装置E中空气赶出,防止NaHSO3 (或Na2S2O4)被氧化;
(4)从溶液中析出的Na2S2O4·2H2O晶体表面有杂质离子,为将杂质洗去,同时降低物质由于洗涤溶解晶体造成的损失,同时便于晶体的干燥,要使用乙醇洗涤Na2S2O4·2H2O;
(5)在装置E中发生反应NaBH4+8NaHSO3 ![]() NaBO2+4Na2S2O4+6H2O,温度在30-40℃下进行,温度低于水的沸点100℃,为便于控制温度及水浴加热具有受热均匀的特点,可采用水浴加热的方式;
NaBO2+4Na2S2O4+6H2O,温度在30-40℃下进行,温度低于水的沸点100℃,为便于控制温度及水浴加热具有受热均匀的特点,可采用水浴加热的方式;
(6)根据4[Fe(CN)6]3-+2S2O42-+8OH-=4[Fe(CN)6]4-+4SO32-+4H2O可知n(Na2S2O4)=![]() n(K3[Fe(CN)6])=
n(K3[Fe(CN)6])=![]() ×0.10mol/L×0.024L×
×0.10mol/L×0.024L×![]() =9.6×10-3mol,m(Na2S2O4)= n(Na2S2O4)×M=9.6×10-3mol×174g/mol=1.6704g,则样品中Na2S2O4的质量分数为(1.6704g÷2.0g)×100%=83.5%。
=9.6×10-3mol,m(Na2S2O4)= n(Na2S2O4)×M=9.6×10-3mol×174g/mol=1.6704g,则样品中Na2S2O4的质量分数为(1.6704g÷2.0g)×100%=83.5%。


科目:高中化学 来源: 题型:
【题目】SO2和NOx是主要大气污染物,利用下图装置可同时吸收SO2和NO。下列有关说法错误的是
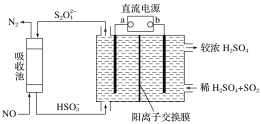
A.a极为直流电源的负极
B.阳极发生的反应式为SO2-2e-+2H2O=SO42-+4H+
C.阴极得到1mol电子时,通过阳离子交换膜的H+为2mol
D.吸收池中发生反应的离子方程式为:2NO+2S2O42-+2H2O=N2+4HSO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用AG表示溶液的酸度,其表达式为AG=lg[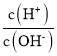 ],298K时,向10mL0.1 molL-1 HX溶液中滴加 0.1molL-1NaOH 溶液。溶液的AG与NaOH溶液体积的关系如图所示。下列说法错误的是 ( )
],298K时,向10mL0.1 molL-1 HX溶液中滴加 0.1molL-1NaOH 溶液。溶液的AG与NaOH溶液体积的关系如图所示。下列说法错误的是 ( )
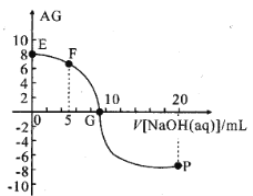
A.溶液pH和AG的关系式为AG=14-2pH
B.对G点溶液,c(Na+) = c(X-)
C.298K时HX的电离常数Ka≈1.0×10-5
D.溶液中水电离的c(OH-) F点<P点
查看答案和解析>>
科目:高中化学 来源: 题型:
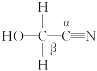
【题目】(1)①丙酮(![]() )分子中碳原子轨道的杂化类型是________,1mol丙酮分子中含有σ键的数目为____________。
)分子中碳原子轨道的杂化类型是________,1mol丙酮分子中含有σ键的数目为____________。
②乙醇的沸点高于丙酮,这是因为__________。
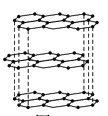
(2)①碳的一种单质的结构如图所示。该单质的晶体类型为______,原子间存在的共价键类型有_______,碳原子的杂化轨道类型为_______________。
②SiCl4分子的中心原子的价层电子对数为_______,分子的立体构型为______,属于______分子(填“极性”或“非极性”)。
③四卤化硅SiX4的沸点和二卤化铅PbX2的熔点如图所示。
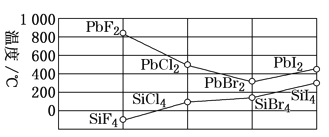
ⅰ.SiX4的沸点依F、Cl、Br、I顺序升高的原因是_____________。
ⅱ.结合SiX4的沸点和PbX2的熔点的变化规律,可推断:依F、Cl、Br、I顺序,PbX2中的化学键的离子性_______、共价性_______。(填“增强”“不变”或“减弱”)
(3)[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:4HCHO+[Zn(CN)4]2-+4H++4H2O=[Zn(H2O)4]2++4HOCH2CN
①1 mol HCHO分子中含有σ键的物质的量为______mol。
②HOCH2CN分子中碳原子轨道的杂化类型为_______。
③与H2O分子互为等电子体的阴离子为_______。
④[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键。不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一瓶签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验:

已知:控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀。
该同学得出的结论正确的是
A. 根据现象1可推出该试液中含有Na+
B. 根据现象2可推出该试液中并不含有葡萄糖酸根
C. 根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+
D. 根据现象5可推出该试液中一定含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年,我国科学家研发出一种新型的锌碘单液流电池,已知M为阴离子交换膜,其原理如图所示。下列说法不正确的是
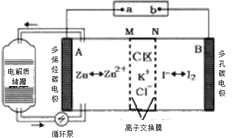
A.放电时A电极反应式为:Zn-2e﹣= Zn2+
B.充电时,B极与外接电源正极相连
C.放电时电解质储罐中离子浓度增大
D.放电时当A极减少65g时,C区Cl﹣增加2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W 是中学化学中常见的四种不同粒子,其中X、W 为分子,Y、Z为离子它们之间存在如下所示的转化关系:
X+Y→Z+W Z+H+ →X Y+H+ →W
(1)如果X、Y、Z、W 均是10电子的粒子,请写出:
X的电子式:____________; W 的电子式:_________________。
(2)如果X和Z均是18电子的粒子,Y 和 W 均是10电子的粒子,请写出:
①X与Y(足量)在溶液中反应的离子方程式:______________________。
②根据上述离子方程式,可判断Z与 Y 结合质子(H+ )的能力大小是 ________ >_____ 。(用化学式或离子符号表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于Na2CO3和NaHCO3两种物质有关性质,说法不正确的是( )
A.向Na2CO3和NaHCO3溶液中,滴入酚酞后溶液均变红
B.Na2CO3固体中含有少量NaHCO3可用加热的方法除去
C.向等质量的Na2CO3和NaHCO3固体中加入足量稀盐酸, Na2CO3产生的气体较多
D.分别向盛有少量Na2CO3和NaHCO3的试管中滴入几滴水,振荡后用温度计测量Na2CO3温度高于NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X为中学化学常见物质,且A、B、C含有相同元素甲,可以发生如下转化关系(水参与的反应,水未标出)。
![]()
(1)若A、B、C的焰色反应呈黄色,C为淡黄色固体,则X是__________。
(2)若A、B、C的焰色反应呈黄色,X是CO2,写出B→C反应的方程式_________。
(3)若B是FeCl3,则X一定是_________,写出B→C反应的离子方程式_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com