
【题目】SO2和NOx是主要大气污染物,利用下图装置可同时吸收SO2和NO。下列有关说法错误的是
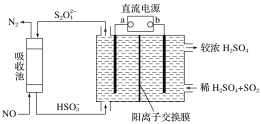
A.a极为直流电源的负极
B.阳极发生的反应式为SO2-2e-+2H2O=SO42-+4H+
C.阴极得到1mol电子时,通过阳离子交换膜的H+为2mol
D.吸收池中发生反应的离子方程式为:2NO+2S2O42-+2H2O=N2+4HSO3-
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(密度为1.84 g/cm3 )配制100 mL l mol/L的稀硫酸。现给出下列仪器(配制过程中可能用到):①100 mL量筒 ②10 mL量筒 ③50 mL烧杯 ④托盘天平 ⑤100 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒,按使用仪器的先后顺序排列正确的是.( )
A.④③⑦⑤⑥;B.②⑤⑦⑥;C.①③⑤⑥⑦;D.②⑥③⑦⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是一种重要的化工原料,某同学设计实验探究工业制备乙烯的原理和乙烯的主要化学性质,实验装置如图所示。

(1)用化学反应方程式解释![]() 装置中的实验现象:________________________。
装置中的实验现象:________________________。
(2)![]() 装置中的现象是________________,其发生反应的类型是________________。
装置中的现象是________________,其发生反应的类型是________________。
(3)查阅资料可知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置________(填序号)中的实验现象可判断该资料是否真实。
(4)通过上述实验探究可知,检验甲烷和乙烯的方是________(填序号,下同);除去甲烷中乙烯的方法是________。
a.将气体通入水中
b.将气体通过装溴水的洗气瓶
c.将气体通过装酸性高锰酸钾溶液的洗气瓶
d.将气体通入氢氧化钠溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
①晶体中分子间作用力越大,分子越稳定 ②原子晶体中共价键越强,熔点越高 ③干冰是CO2分子通过氢键和分子间作用力有规则排列成的分子晶体 ④在Na2O和Na2O2晶体中,阴、阳离子数之比相等 ⑤正四面体构型的分子,键角都是109°28′,其晶体类型可能是原子晶体或分子晶体 ⑥分子晶体中都含有化学键 ⑦含4.8 g碳元素的金刚石晶体中的共价键的物质的量为0.8 mol
A. ①②③④⑤ B. ②④⑦ C. ⑤⑥⑦ D. ③④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是
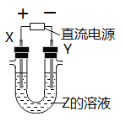
A.氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠
B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4
C.海水提镁中,X、Y均为石墨,Z为MgCl2溶液
D.电镀工业中,X是镀层金属,Y是待镀金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Cu与CuO的混合物20.8g加入到50mL 18.4mol/L浓H2SO4中,加热充分反应至固体物质完全溶解(产生气体全部逸出),冷却后将溶液稀释至1000ml,测得c(H+)=0.84mol/L;若要使稀释后溶液中的Cu2+沉淀完全,应加入6.0mol/L的NaOH溶液的体积为:
A.100mLB.160mLC.240mLD.307mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,已知部分弱酸的电离平衡常数如下表:
弱酸 | CH3COOH | H2S | H2CO3 | H2SO3 |
电离平衡常数(25 ℃) | K=10-5 | K1=1.3×10 -7 K2=7.1×10 -15 | K1=4.4×10 -7 K2=4.7×10 -11 | K1=1.3×10 -2 K2=6.3×10 -8 |
请回答下列问题:
(1)H2S 的第二级电离平衡常数的表达式 K2=______
(2)25℃时,若 CH3COOH 的起始浓度为 0.1 mol·L -1,则平衡时 c(H+)=____mol/L,由水电离的出的 c(H+)=____mol/L。
(3)(A)相同浓度的①CH3COONa 溶液、②Na2CO3溶液、③Na2S溶液、④NaHSO3溶液和⑤Na2SO3溶液,pH 由大到小排序为________(用序号表示)
(B)纯碱可代替洗涤剂洗涤餐具,原因是(用离子方程式表示)___________
(4)pH 均为 5硫酸和醋酸两份溶液,把硫酸溶液稀释 1000 倍,则 c(H+)/c(SO42-)=___;把醋酸稀释 100 倍,pH 范围为_____
(5)将少量H2S气体通入到 Na2CO3溶液中发生反应的离子方程式为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现取m克铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加bmol/LNaOH溶液,当滴加到VmL时,得到沉淀质量恰好为最大值n克,则下列有关该实验的说法中不正确的是 ( )
A. 沉淀中氢氧根的质量为(n-m)克
B. 恰好溶解后溶液中的NO3-离子的物质的量为![]() mol
mol
C. 生成标准状况下NO气体的体积为![]() L
L
D. 与合金反应反应的硝酸的物质的量为(![]() +
+![]() )mol
)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保险粉(Na2S2O4)广泛应用于造纸、印染、环保、医药等行业。该物质具有强还原性,在空气中易被氧化,受热易分解,在碱性条件下比较稳定,易溶于水、不溶于乙醇。保险粉可以通过 NaHSO3与NaBH4反应制取。请按要求回答下列问题:
I.NaHSO3溶液的制备
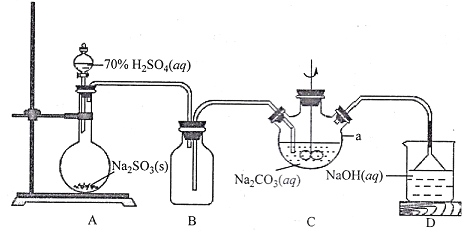
(1)上图仪器a的名称___________;装置C中反应后溶液pH=4.1,则发生反应的化学方程式为___________。
II.保险粉的制备
打开下图(部分装置已省略)中活塞K1通入氮气,一段时间后,关闭K1,打开恒压滴液漏斗活塞向装置E中滴入碱性NaBH4溶液,在30-40℃下充分反应。向反应后的溶液中加入乙醇,经冷却结晶、过滤得到Na2S2O4·2H2O晶体,再用乙醇洗涤、真空烘干脱去晶体结晶水得到保险粉。
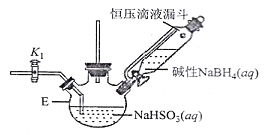
(2)反应产物中有NaBO2,无气体。写出E中发生反应的化学方程式___________。
(3)通入氮气的作用是______________________。
(4)使用乙醇洗涤Na2S2O4·2H2O晶体的优点:______________________。
(5)对装置E的加热方式最好采用______________________。
Ⅲ.保险粉的纯度测定
(6)称取2.0g Na2S2O4样品溶于冷水配成200mL溶液,取出25.00mL该溶液于锥形瓶中,用0.10mol/L碱性K3[Fe(CN)6]标准溶液滴定,原理为:4[Fe(CN)6]3-+2S2O42-+8OH-=4[Fe(CN)6]4-+4SO32-+4H2O,用亚甲基蓝为指示剂,达到滴定终点时消耗标准溶液24.00mL,则样品中Na2S2O4的质量分数为___________(杂质不参与反应)(计算结果精确至0.1%)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com