
【题目】常温时,已知部分弱酸的电离平衡常数如下表:
弱酸 | CH3COOH | H2S | H2CO3 | H2SO3 |
电离平衡常数(25 ℃) | K=10-5 | K1=1.3×10 -7 K2=7.1×10 -15 | K1=4.4×10 -7 K2=4.7×10 -11 | K1=1.3×10 -2 K2=6.3×10 -8 |
请回答下列问题:
(1)H2S 的第二级电离平衡常数的表达式 K2=______
(2)25℃时,若 CH3COOH 的起始浓度为 0.1 mol·L -1,则平衡时 c(H+)=____mol/L,由水电离的出的 c(H+)=____mol/L。
(3)(A)相同浓度的①CH3COONa 溶液、②Na2CO3溶液、③Na2S溶液、④NaHSO3溶液和⑤Na2SO3溶液,pH 由大到小排序为________(用序号表示)
(B)纯碱可代替洗涤剂洗涤餐具,原因是(用离子方程式表示)___________
(4)pH 均为 5硫酸和醋酸两份溶液,把硫酸溶液稀释 1000 倍,则 c(H+)/c(SO42-)=___;把醋酸稀释 100 倍,pH 范围为_____
(5)将少量H2S气体通入到 Na2CO3溶液中发生反应的离子方程式为______
【答案】(H+)(S2-)/(HS-) 0.001 10-11 ③②⑤①④ CO32-+H2O![]() HCO3-+OH- 2:1 5<pH<7 H2S+CO32-===HCO3-+HS-
HCO3-+OH- 2:1 5<pH<7 H2S+CO32-===HCO3-+HS-
【解析】
(1)H2S的二级电离方程式为HS-S2-+H+,可求电离平衡常数表达式;
(2)25℃时,CH3COOH的电离平衡常数K=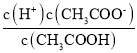 =10-5;
=10-5;
(3)(A)①CH3COONa,②Na2CO3,③Na2S,④NaHSO3,⑤Na2SO3溶液都是强碱弱酸盐,水溶液呈碱性,对应酸的酸性越弱,水解程度越大,溶液中氢氧根离子浓度越大,pH越大;
(B)纯碱的成分是碳酸钠,在水溶液中会发生水解:CO32- +H2O![]() HCO3-+ OH-;
HCO3-+ OH-;
(4)pH为5的硫酸溶液中氢离子浓度为:c(H+)=1×10-5mol/L,硫酸根离子的浓度为:c(SO42-)=0.5×1×10-5mol/L=5×10-6mol/L,溶液稀释1000倍后,氢离子浓度不可能小于1×10-7mol/L,只能无限接近1×10-7mol/L,而硫酸根离子浓度为:c(SO42-)=5×10-6mol/L×0.001=5×10-9mol/L,所以稀释后溶液中SO42-离子浓度与H+离子浓度的比值约为:5×10-9mol/L:1×10-7mol/L=1:2;pH 均为 5的醋酸溶液稀释 1000 倍,溶液的pH<7,不可能呈碱性,并且稀释后酸性肯定比原来的弱,pH>5,故pH 范围为5<pH<7;
(5)将少量H2S气体通入到 Na2CO3溶液会生成碳酸氢钠和硫氢化钠。
(1)H2S的二级电离方程式为HS-S2-+H+,则电离平衡常数表达式为Ka1=![]() ;
;
(2)25℃时,CH3COOH的电离平衡常数K=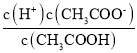 =10-5,
=10-5,![]() =0.1mol/L,设c(H+)=c(CH3COO-)=x,带入K中得
=0.1mol/L,设c(H+)=c(CH3COO-)=x,带入K中得![]() =10-5,解得x= c(H+)=0.001mol/L;由水电离的出的 c(H+)等于由水电离的出的 c(OH-),25℃时溶液中c(H+) c(OH-)=0.001mol/L c(OH-)=10-14,得水电离的出的c(OH-)=10-11mol/L;
=10-5,解得x= c(H+)=0.001mol/L;由水电离的出的 c(H+)等于由水电离的出的 c(OH-),25℃时溶液中c(H+) c(OH-)=0.001mol/L c(OH-)=10-14,得水电离的出的c(OH-)=10-11mol/L;
(3)(A)①CH3COONa,②Na2CO3,③Na2S,④NaHSO3,⑤Na2SO3溶液都是强碱弱酸盐,水溶液呈碱性,对应酸的酸性越弱,水解程度越大,溶液中氢氧根离子浓度越大,pH越大,由表可知对应酸的酸性大小为HS-<HCO3-<HSO3-<CH3COOH<H2SO3,pH由大到小排序为③②⑤①④;
(B)纯碱的成分是碳酸钠,在水溶液中会发生水解:CO32- +H2O![]() HCO3
HCO3
(4)pH为5的硫酸溶液中氢离子浓度为:c(H+)=1×10-5mol/L,硫酸根离子的浓度为:c(SO42-)=0.5×1×10-5mol/L=5×10-6mol/L;溶液稀释1000倍后,氢离子浓度不可能小于1×10-7mol/L,只能无限接近1×10-7mol/L,而硫酸根离子浓度为:c(SO42-)=5×10-6mol/L×0.001=5×10-9mol/L,所以稀释后溶液中SO42-离子浓度与H+离子浓度的比值约为:5×10-9mol/L:1×10-7mol/L=1:2;pH 均为 5的醋酸溶液稀释 1000 倍,溶液的pH<7,不可能呈碱性,并且稀释后酸性肯定比原来的弱,pH>5,故pH 范围为5<pH<7;
(5)将少量H2S气体通入到 Na2CO3溶液会生成碳酸氢钠和硫氢化钠,离子方程式为:H2S+CO32-===HCO3-+HS-;
(6)由电荷守恒可知c(H+)+c(NH4+)=2c(SO32-)+c(HSO3-)+c(OH-),


科目:高中化学 来源: 题型:
【题目】苏联科学家欧巴林教授在其著作中曾说:“生命起源于甲烷”,英国科学家巴纳尔教授则认为生命是从二氧化碳和水开始的。与之相关的转化关系如图所示(部分反应条件已略去):

(1)A的结构式为________;C中官能团的电子式为________;反应②的反应类型为________。
(2)写出下列物质的结构简式:D________;H________。
(3)C→D的化学方程式为__________;二氧化碳和水经光合作用生成葡萄糖的化学方程式为_________。
(4)在自然界中纤维素与水可在甲烷菌的催化作用下生成甲烷和二氧化碳,写出该反应的化学方程式并配平:
_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知以下反应中的四种物质由三种元素组成,其中a的分子立体构型为正四面体形,组成a物质的两种元素的原子序数之和小于10,组成b物质的元素为第三周期元素。下列判断正确的是
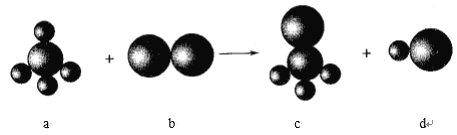
A. 四种分子中的化学键均是极性键
B. a、c分子中中心原子均采用sp3杂化
C. 四种分子中既有σ键,又有π键
D. b、d分子中共价键的键能:b>d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2和NOx是主要大气污染物,利用下图装置可同时吸收SO2和NO。下列有关说法错误的是
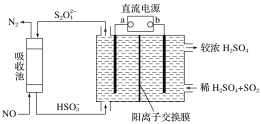
A.a极为直流电源的负极
B.阳极发生的反应式为SO2-2e-+2H2O=SO42-+4H+
C.阴极得到1mol电子时,通过阳离子交换膜的H+为2mol
D.吸收池中发生反应的离子方程式为:2NO+2S2O42-+2H2O=N2+4HSO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中含有哑铃形的![]() ,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法正确的是( )
,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法正确的是( )

A.每个Ca2+周围距离最近且相等的![]() 的数目为6
的数目为6
B.该晶体中的阴离子与F2是等电子体
C.6.4g CaC2晶体中含有0.1mol阴离子
D.每个Ca2+周围距离最近且相等的Ca2+有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
[探究一](1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是_____________________。
(2)称取碳素钢6.0 g放入15.0 mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用_______(选填序号)。
A.KSCN溶液和氯水 B.铁粉和KSCN溶液C.浓氨水 D.酸性KMnO4溶液
②乙同学取560 mL(标准状况)气体Y通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4反应,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66 g。由此推知气体Y中SO2的体积分数为_______。
[探究二]根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体,在标准状况下,密度为0.0893 g·L-1。为此设计了下列探究实验装置(假设有关气体完全反应)。
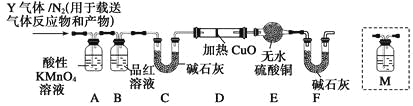
(3)装置B中试剂的作用是_______________________。
(4)分析Y气体中的Q2气体是如何生成的_____________(用化学方程式表示)。
(5)已知洗气瓶M中盛装澄清石灰水,为确认Q2的存在,需在装置中添加洗气瓶M于_______(填序号)。
A.A之前 B.A—B间
C.B—C间 D.C—D间
(6)如果气体Y中含有Q1,预计实验现象应是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石蜡油分解可产生乙烯。乙烯是一种重要的化工原料,某同学设计实验探究工业制备乙烯的原理和乙烯的主要化学性质,实验装置如图所示。
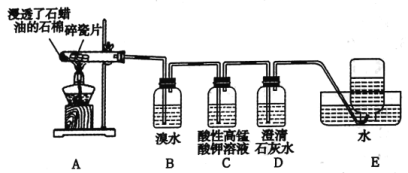
(1)用化学反应方程式解释B装置中的实验现象:_________。
(2)C装置中的现象是_________,其发生反应的类型是__________。
(3)查阅资料可知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置_______(填序号)中的实验现象可判断该资料是否真实。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用AG表示溶液的酸度,其表达式为AG=lg[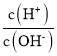 ],298K时,向10mL0.1 molL-1 HX溶液中滴加 0.1molL-1NaOH 溶液。溶液的AG与NaOH溶液体积的关系如图所示。下列说法错误的是 ( )
],298K时,向10mL0.1 molL-1 HX溶液中滴加 0.1molL-1NaOH 溶液。溶液的AG与NaOH溶液体积的关系如图所示。下列说法错误的是 ( )
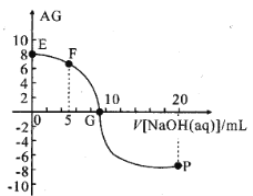
A.溶液pH和AG的关系式为AG=14-2pH
B.对G点溶液,c(Na+) = c(X-)
C.298K时HX的电离常数Ka≈1.0×10-5
D.溶液中水电离的c(OH-) F点<P点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W 是中学化学中常见的四种不同粒子,其中X、W 为分子,Y、Z为离子它们之间存在如下所示的转化关系:
X+Y→Z+W Z+H+ →X Y+H+ →W
(1)如果X、Y、Z、W 均是10电子的粒子,请写出:
X的电子式:____________; W 的电子式:_________________。
(2)如果X和Z均是18电子的粒子,Y 和 W 均是10电子的粒子,请写出:
①X与Y(足量)在溶液中反应的离子方程式:______________________。
②根据上述离子方程式,可判断Z与 Y 结合质子(H+ )的能力大小是 ________ >_____ 。(用化学式或离子符号表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com