
【题目】25 ℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
A.0.1 mol·L-1 CH3COONa溶液与0.1 mol·L-1 HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-)
B.0.1 mol·L-1 NH4Cl溶液与0.1 mol·L-1氨水等体积混合(pH>7):c(NH3·H2O)>c(NH![]() )>c(Cl-)>c(OH-)
)>c(Cl-)>c(OH-)
C.0.1 mol·L-1 Na2CO3溶液与0.1 mol·L-1 NaHCO3溶液等体积混合:![]() c(Na+)=c(CO
c(Na+)=c(CO![]() )+c(HCO
)+c(HCO![]() )+c(H2CO3)
)+c(H2CO3)
D.0.1 mol·L-1 Na2C2O4溶液与0.1 mol·L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O![]() )+c(HC2O
)+c(HC2O![]() )+c(OH-)=c(Na+)+c(H+)
)+c(OH-)=c(Na+)+c(H+)
【答案】A
【解析】
A、0.1 mol·L-1 CH3COONa溶液与0.1 mol·L-1 HCl溶液等体积混合,溶质为等物质的量的CH3COOH和NaCl,醋酸为弱酸,部分电离,所以c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-),A选项正确;
B、0.1 mol·L-1 NH4Cl溶液与0.1 mol·L-1氨水等体积混合,pH>7,说明一水合氨的电离程度大于铵根离子的水解程度,若不考虑NH4+水解和NH3·H2O的电离,则c(NH4+)= c(NH3·H2O)=c(Cl-),在考虑溶液中水解平衡和电离平衡后,因一水合氨的电离程度大于铵根离子的水解程度,则c(NH4+)>c(Cl-)>c(NH3·H2O)> c(OH-),B选项错误;
C、根据物料守恒,0.1 mol·L-1Na2CO3溶液中,c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),0.1 mol·L-1 NaHCO3溶液中,c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),二者等体积混合,则2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3),即![]() c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),C选项错误;
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),C选项错误;
D、0.1 mol·L-1 Na2C2O4溶液与0.1 mol·L-1 HCl溶液等体积混合,溶质为等物质的量的NaHC2O4和NaCl,根据电荷守恒:c(Na+)+c(H+)=2c(C2O42-)+c(HC2O4-)+c(OH-)+c(Cl-),D选项错误;
故答案为A。


科目:高中化学 来源: 题型:
【题目】铁的某种氧化物20 g,在加热的条件下通入足量的CO完全反应,将生成的气体用石灰水吸收,得到沉淀37.5 g,求该氧化物中铁元素与氧元素的质量比。_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是生命之源,与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)H2O水分子的VSEPR模型为_______形,氧原子的杂化方式为_____
(2)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+),用电子式表示它的形成过程为___________________________,
(3)对于(2)中涉及的变化过程的描述不合理的是________。
a.氧原子的杂化类型发生了改变 b.微粒的形状发生了改变
c.微粒的化学性质发生了改变 d.微粒中的键角发生了改变
(4)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol(设气态水中无氢键)。
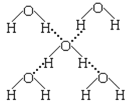
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)已知X、Y、Z、M、G、Q是六种短周期元素,原子序数依次增大。X、Z、Q的单质在常温下呈气态;Y的原子最外层电子数是其电子层数的2倍;X与M同主族;Z、G分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)Y、Z、M、G四种元素原子半径由大到小的顺序是(写元素符号) 。
(2)Z在元素周期表中的位置为 。
(3)上述元素的最高价氧化物对应的水化物酸性最强的是(写化学式) 。
(4)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式) ,在实验室中,制取该物质的反应原理是(写化学方程式) 。
(5)M2Z的电子式为 。MX与水反应可放出气体,该反应的化学方程式为 。
(6)常温下,不能与G的单质发生反应的是(填序号) 。
a.CuSO4溶液 b.Fe2O3c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
工业上用电解法制G的单质的化学方程式是 ,若以石墨为电极,阳极产生的混合气体的成分是(写化学式) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中微粒的物质的量浓度关系不正确的是![]()
A.若将适量![]() 通入
通入![]()
![]()
![]() 溶液中至溶液恰好呈中性,则溶液中
溶液中至溶液恰好呈中性,则溶液中![]() 不考虑溶液体积变化
不考虑溶液体积变化![]() :2
:2![]()
![]()
![]()
B.某溶液中由水电离出的![]() ,若
,若![]() 时,则该溶液pH一定为
时,则该溶液pH一定为![]()
C.常温下将相同体积的![]() 硫酸和
硫酸和![]() 一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性
一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性
D.等体积等物质的量浓度的NaClO溶液与NaCl溶液中离子总数大小:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 将pH均为a的NaOH溶液和氨水分别加水稀释100倍,pH分别变为b和c,则a、b、c的大小关系为b>c>a
B. 常温下0.1 molL-1 KHA溶液的pH=3,则该溶液中C(A2- )<c(H2A)
C. 室温时 M(OH)2(s)![]() M2+(aq)+2OH-(aq) Ksp=a,则当 c(M2+)=b molL-1 时,溶液的pH为14 +
M2+(aq)+2OH-(aq) Ksp=a,则当 c(M2+)=b molL-1 时,溶液的pH为14 +![]() 1g
1g![]()
D. 0.1 molL-1 Na2CO3溶液:c(OH-)=c(H+)+c(HCO3-)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.300℃时将2molA和2molB两种气体混合于2L密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g) △H,2min末达到平衡,生成0.8moLD。
(1)300℃时,该反应的平衡常数表达式为K=________,已知K300℃<K350℃,则△H________(填“>”或“<” 0).
(2)在2min末时,B的平衡浓度为________,D的平均反应速率为________。
(3)若温度不变,缩小容器容积,则A的转化率________![]() 填“增大”“减小”或“不变”
填“增大”“减小”或“不变”![]() 。
。
II.在一定条件下,可逆反应:mA+nBpC达到平衡,若:
(1)A、B、C都是气体,减小压强,平衡向正反应方向移动,则,m+n________(填“>”“<”或“![]() ” p)。
” p)。
(2)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是________。
(3)加热后,可使C的质量增加,则正反应是________(填“放热”或“吸热”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 向盛有一定量烧碱溶液的烧杯中通入一定量的CO2 气体后,再向所得溶液中逐滴加入盐酸至过量,产生的 CO2 气体与加入 HCl 的物质的量的关系如图所示(忽略 CO2 的溶解和 HCl的挥发):
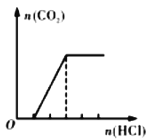
请问图中O点对应溶液的溶质为_____(填化学式),其物质的量之比为_____。开始产生 CO2 气体时对应的离子方程式为_____。
II.SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。
(1)SCR(选择性催化还原)工作原理:
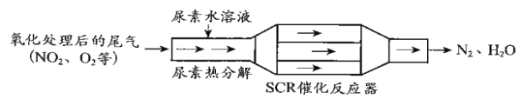
①尿素水溶液热分解为NH3和CO2,该反应的化学方程式:___________。
②反应器中NH3还原NO2的化学方程式:____________。
③当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒。用化学方程式表示(NH4)2SO4的形成:_____________。
(2)NSR技术通过BaO和Ba(NO3)2的相互转化实现NOx(氮氧化物)的储存和还原,能有效降低柴油发动机在空气过量条件下的NOx排放。其工作原理如图所示。
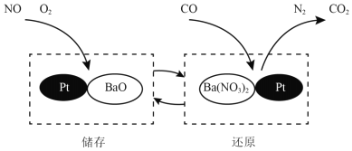
①储存时,吸收NOx(如NO、NO2)的物质是______。
②还原时,在一定条件下发生反应的化学方程式为:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究人员利用![]() 水解生成的盐酸和石灰石
水解生成的盐酸和石灰石![]() 含少量
含少量![]() 、
、![]() 、
、![]() 、
、![]() 杂质
杂质![]() 生产医用二水合氯化钙晶体的简化工艺流程为图1:
生产医用二水合氯化钙晶体的简化工艺流程为图1:
已知:![]() 、
、![]() 完全沉淀的pH分别是
完全沉淀的pH分别是![]() 、
、![]() .
.
回答下列问题:
(1)滤渣A的主要成分是____________;操作X的方法为____________.
(2)控制在![]() 时
时![]() 水解的化学方程式为____________.
水解的化学方程式为____________.
(3)![]() 含80%CaCCO3的石灰石理论上最多能生成
含80%CaCCO3的石灰石理论上最多能生成![]() 的质量为____________t,制得的二水合氯化钙晶体中存在的少量杂质可能是____________.
的质量为____________t,制得的二水合氯化钙晶体中存在的少量杂质可能是____________.
(4)尾气中含污染气体![]() ,利用图2所示电化学装置可吸收
,利用图2所示电化学装置可吸收![]() 气体,从而减少大气污染,阳极的电极反应式为____________.
气体,从而减少大气污染,阳极的电极反应式为____________.

(5)制二水合氯化钙晶体所需热量可由甲醇燃烧提供,如图3为一定条件下![]() 与
与![]() 发生反应时,生成CO、
发生反应时,生成CO、![]() 或HCHO的能量变化图
或HCHO的能量变化图![]() 反应物
反应物![]() 和生成物
和生成物![]() 已略去
已略去![]() 则
则![]() 的
的![]() ____________.
____________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com