
����Ŀ������˵����ȷ���ǣ� ��
A. ��pH��Ϊa��NaOH��Һ�Ͱ�ˮ�ֱ��ˮϡ��100����pH�ֱ��Ϊb��c����a��b��c�Ĵ�С��ϵΪb>c>a
B. ������0.1 molL-1 KHA��Һ��pH=3�������Һ��C(A2- )<c(H2A)
C. ����ʱ M(OH)2(s)![]() M2+(aq)+2OH-(aq) Ksp=a���� c(M2��)=b molL-1 ʱ����Һ��pHΪ14 +
M2+(aq)+2OH-(aq) Ksp=a���� c(M2��)=b molL-1 ʱ����Һ��pHΪ14 +![]() 1g
1g![]()
D. 0.1 molL-1 Na2CO3��Һ��c(OH-)=c(H��)+c(HCO3-)+c(H2CO3)
���𰸡�C
��������A����ˮϡ������������Һ�Ͱ�ˮ��c(OH-)����С����ˮϡ�ʹٽ�һˮ�ϰ����룬��ϡ�ͺ�ˮ��pH�����������ƣ���a��b��c�Ĵ�С��ϵ�ǣ�a��c��b����A����B��������0.1 molL-1 KHA��Һ��pH=3��˵��HA-����Һ�в��ֵ���������ӣ���HA-�ĵ���̶ȴ�����ˮ��̶ȣ���c(A2-)��c(H2A)����B����
C��Ksp=c(M2+)��c2(OH-)=a����c(OH-)=![]() mol/L��������������Ũ��Ϊ��c(H+)=
mol/L��������������Ũ��Ϊ��c(H+)=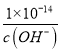 �������Һ��pH=-lgc(H+)=-lg
�������Һ��pH=-lgc(H+)=-lg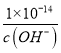 =-lg-lg
=-lg-lg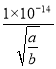 =14 +
=14 +![]() 1g
1g![]() ����C��ȷ��D��0.1 molL-1 Na2CO3��Һ�У����������غ�ɵã�c(OH-)=c(H��)+c(HCO3-)+2c(H2CO3)����D����ΪC��
����C��ȷ��D��0.1 molL-1 Na2CO3��Һ�У����������غ�ɵã�c(OH-)=c(H��)+c(HCO3-)+2c(H2CO3)����D����ΪC��


 ȫ�̽��ϵ�д�
ȫ�̽��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£���3molA��1molB�����������ڹ̶��ݻ�Ϊ2L���ܱ������У��������·�Ӧ��3A��g��+B��g��![]() xC��g��+2D��g����2minĩ�÷�Ӧ�ﵽƽ�⣬����0.8molD�������C��Ũ��Ϊ0.2molL-1�������жϴ������
xC��g��+2D��g����2minĩ�÷�Ӧ�ﵽƽ�⣬����0.8molD�������C��Ũ��Ϊ0.2molL-1�������жϴ������
A. x=1B. �����������ܶȲ���������÷�Ӧ�ﵽƽ��״̬
C. B��ת����Ϊ40%D. 2min��A�ķ�Ӧ����Ϊ0.3molL-1min-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ�����Ӧ��������������ǣ� ��

A.ͼ1��ʾ�����£�ϡ��HA��HB�������ϡ��Һʱ����ҺpH���ˮ���ı仯����NaA��Һ��pHС��ͬŨ�ȵ�NaB��Һ��pH
B.ͼ2��ʾ KNO3 ���ܽ�����ߣ�a����ʾ����Һ��80��ʱKNO3�IJ�������Һ
C.ͼ3 ��ʾij���ȷ�Ӧ�ֱ����С�����������·�Ӧ�����е������仯
D.ͼ4��ʾ���º��������£�2NO2(g)![]() N2O4(g)�У������ʵ�Ũ��������������֮��Ĺ�ϵ�����н���A��Ӧ��״̬Ϊ��ѧƽ��״̬
N2O4(g)�У������ʵ�Ũ��������������֮��Ĺ�ϵ�����н���A��Ӧ��״̬Ϊ��ѧƽ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�pH=1��ij��ҺA�к���NH4+��K+��Na+��Fe3+��Al3+��Fe2+��CO32-��NO3-��Cl-��I-��SO42���е�4�֣�����Һ�������ӵ����ʵ���Ũ�Ⱦ�Ϊ0.1mol/L����ȡ����Һ�����й�ʵ�飬ʵ��������ͼ��ʾ�� �����й�˵����ȷ����

A������Һ��һ�������������е�NO3-��Al3+��SO42����Cl-��������
B��ʵ������Cu 14.4g,���������嶡�����Ϊ3.36L
C��������һ����BaCO3��������BaSO4
D��һ��û��Fe3+��������ȷ���Ƿ���I-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25 ��ʱ�������й���Һ���������ʵ���Ũ�ȹ�ϵ��ȷ����(����)
A.0.1 mol��L��1 CH3COONa��Һ��0.1 mol��L��1 HCl��Һ�������ϣ�c(Na��)��c(Cl��)��c(CH3COO��)��c(OH��)
B.0.1 mol��L��1 NH4Cl��Һ��0.1 mol��L��1��ˮ��������(pH��7)��c(NH3��H2O)��c(NH![]() )��c(Cl��)��c(OH��)
)��c(Cl��)��c(OH��)
C.0.1 mol��L��1 Na2CO3��Һ��0.1 mol��L��1 NaHCO3��Һ�������ϣ�![]() c(Na��)��c(CO
c(Na��)��c(CO![]() )��c(HCO
)��c(HCO![]() )��c(H2CO3)
)��c(H2CO3)
D.0.1 mol��L��1 Na2C2O4��Һ��0.1 mol��L��1 HCl��Һ��������(H2C2O4Ϊ��Ԫ����)��2c(C2O![]() )��c(HC2O
)��c(HC2O![]() )��c(OH��)��c(Na��)��c(H��)
)��c(OH��)��c(Na��)��c(H��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. �����ܱ������н��еķ�Ӧ��A��s����3B��g��![]() 2C��g����D��g������������ܶȱ��ֲ��䣬˵����Ӧ�Ѿ��ﵽƽ��
2C��g����D��g������������ܶȱ��ֲ��䣬˵����Ӧ�Ѿ��ﵽƽ��
B. C ( s) + H2O (g) ![]() CO ( g) + H2 (g)�������������䣬��С��������������ʼ�С������������
CO ( g) + H2 (g)�������������䣬��С��������������ʼ�С������������
C. N2(g) + 3H2(g)![]() 2NH3(g) ��H=��93kJ��mol��1���������ܱ������г���0.4 molN2(g)��2 mol H2(g)�ﵽƽ��ʱ�����Էų�37.2 kJ������
2NH3(g) ��H=��93kJ��mol��1���������ܱ������г���0.4 molN2(g)��2 mol H2(g)�ﵽƽ��ʱ�����Էų�37.2 kJ������
D. A(g)+ 3B (g) ![]() 2C (g) + D (g)�������ֲ�ͬ����µķ�Ӧ���ʷֱ�Ϊ����
2C (g) + D (g)�������ֲ�ͬ����µķ�Ӧ���ʷֱ�Ϊ����![]() ����
����![]() ����ǰ�߱Ⱥ��߿�
����ǰ�߱Ⱥ��߿�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾʾ��ͼ������˵������ȷ����
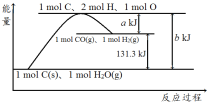
A. ��Ӧ���Ȼ�ѧ����ʽ�ɱ�ʾΪC(s)+H2O(g)![]() CO(g)+H2(g) ��H=(b-a) kJ��mol-1
CO(g)+H2(g) ��H=(b-a) kJ��mol-1
B. �÷�Ӧ���̷�Ӧ��ϼ����յ�����һ������������ɼ��ų�������
C. ʹ�ô������ı�÷�Ӧ����H
D. nmol C��n mol H2O��Ӧ����nmol CO��nmol H2���յ�����һ��Ϊ131.3nkJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼװ���У�U�ι���Ϊ��īˮ��a��b�Թ��ڷֱ�ʢ��ʳ��ˮ�ʹ�����Һ�������������飬����һ��ʱ�䡣�����й���������ȷ����

A.�������е�̼��ԭ��ص�����
B.��īˮˮ�����ߵ�Һ���Ϊ����Ҹ�
C.���Թ�����ͬ�ĵ缫��Ӧʽ��Fe-2e- = Fe2��
D.a�Թ��з�����������ʴ��b�Թ��з��������ⸯʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶����ù���������ϡ���ᷴӦ��ȡ��������ȡ���д�ʩ���ٽ����黻Ϊ�����������ۣ��ڼ�������![]() ��Һ���ۼ�������
��Һ���ۼ�������![]() ���壻�ܼ�������ˮ���ݼ��ȣ���ϡ���ỻΪ98%�����ᣬ���п���߷�Ӧ���ʵĴ�ʩ������
���壻�ܼ�������ˮ���ݼ��ȣ���ϡ���ỻΪ98%�����ᣬ���п���߷�Ӧ���ʵĴ�ʩ������
A.�٢ۢ�B.�٢ۢ�C.�ڢܢ�D.�ڢݢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com