
【题目】Ni(CO)4可用于有机合成,也常用作催化剂。一定条件下,恒容密闭容器中发生反应Ni(s)+4CO(g)![]() Ni(CO)4(g),该反应的平衡常数与温度的关系如下表所示:
Ni(CO)4(g),该反应的平衡常数与温度的关系如下表所示:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法正确的是
A.25℃达到平衡时,向容器中继续充入CO(g),CO的转化率减小
B.温度越低,越有利于Ni(CO)4的生产
C.80℃时,测得某时刻Ni(CO)4、CO的浓度均为0.5 mol·L-1,则此时v正<v逆
D.平衡后,向密闭容器中加入少量镍粉,平衡正向移动,达到新平衡时CO的浓度比原平衡小
【答案】C
【解析】
A.向容器中继续通入CO(g),相当于增大压强,化学平衡正向进行,CO转化率增大,A错误;
B.由图表数据可知,温度升高,化学平衡常数减小,说明该反应的正反应是放热反应,降低温度,化学平衡正向进行,但反应速率小,生产效益低,不利于Ni(CO)4的生产,B错误;
C.依据浓度商计算和平衡常数比较分析判断反应进行方向,在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol/L,Qc=![]() =8>K=2,化学反应逆向进行,因此此时v正<v逆,C正确;
=8>K=2,化学反应逆向进行,因此此时v正<v逆,C正确;
D.固体物质浓度不变,因此平衡后,向密闭容器中加入少量镍粉,对化学平衡无影响,平衡不移动,CO的浓度不变,D错误;
故合理选项是C。


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】请按要求填空:
(1)写出![]() 中含氧官能团的名称_______________;
中含氧官能团的名称_______________;
(2)![]() 属于__________类化合物;
属于__________类化合物;
(3)CH2=CH—CH3在催化剂加热条件下生成聚合物的反应方程式为________;
(4)写出实验室制乙炔的化学反应方程式_________________;
(5)①称取3.4g某有机化合物A,完全燃烧后生成1.8g H2O和8.8g CO2,已知该有机物的蒸气对氢气的相对密度为68,则该有机物的分子式为_________________;
②该有机物A的核磁共振氢谱和红外光谱如下:

试推测有机物A的结构简式为_________________________;
③与A属于同类有机物的同分异构体包括A共有_________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,pH=2的HA和HB各1 mL分别加水稀释,pH随溶液体积变化如图所示。下列叙述正确的是

A. Kw的数值:a点大于c点
B. 溶液中的总酸量:a点大于b点
C. HB的电离程度:b点大于c点
D. 将a点与b点两溶液同时升高温度,则![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中微粒的物质的量浓度关系不正确的是![]()
A.若将适量![]() 通入
通入![]()
![]()
![]() 溶液中至溶液恰好呈中性,则溶液中
溶液中至溶液恰好呈中性,则溶液中![]() 不考虑溶液体积变化
不考虑溶液体积变化![]() :2
:2![]()
![]()
![]()
B.某溶液中由水电离出的![]() ,若
,若![]() 时,则该溶液pH一定为
时,则该溶液pH一定为![]()
C.常温下将相同体积的![]() 硫酸和
硫酸和![]() 一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性
一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性
D.等体积等物质的量浓度的NaClO溶液与NaCl溶液中离子总数大小:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热N2O5,依次发生的分解反应:①N2O5(g)![]() N2O3(g)+O2(g),②N2O3(g)
N2O3(g)+O2(g),②N2O3(g)![]() N2O(g)+O2(g);在体积为2L密闭容器中充入8molN2O5,加热到t℃,达到平衡状态。此时O2为9mol, N2O3为3.4mol。则t℃时反应①的平衡常数为
N2O(g)+O2(g);在体积为2L密闭容器中充入8molN2O5,加热到t℃,达到平衡状态。此时O2为9mol, N2O3为3.4mol。则t℃时反应①的平衡常数为
A. 10.7 B. 8.5 C. 9.6 D. 10.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.300℃时将2molA和2molB两种气体混合于2L密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g) △H,2min末达到平衡,生成0.8moLD。
(1)300℃时,该反应的平衡常数表达式为K=________,已知K300℃<K350℃,则△H________(填“>”或“<” 0).
(2)在2min末时,B的平衡浓度为________,D的平均反应速率为________。
(3)若温度不变,缩小容器容积,则A的转化率________![]() 填“增大”“减小”或“不变”
填“增大”“减小”或“不变”![]() 。
。
II.在一定条件下,可逆反应:mA+nBpC达到平衡,若:
(1)A、B、C都是气体,减小压强,平衡向正反应方向移动,则,m+n________(填“>”“<”或“![]() ” p)。
” p)。
(2)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是________。
(3)加热后,可使C的质量增加,则正反应是________(填“放热”或“吸热”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种黄绿色易溶于水的气体,常用作饮用水消毒。实验室通过如下过程制备二氧化氯。下列说法正确的是

A. 电解时发生反应的离子方程式为NH4++3Cl-![]() 2H2↑+NCl3
2H2↑+NCl3
B. 溶液X中大量存在的阴离子有Cl-、OH-
C. 可用饱和食盐水除去ClO2中的NH3
D. 常用作净水剂的明矾可除去饮用水中残留的NaClO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种白色晶体,能潮解,难溶于水,可与水缓慢反应,不溶于乙醇,易与酸反应,常用作杀菌剂、防腐剂等。根据题意,回答相关问题。
I.CaO2晶体的制备:CaO2晶体通常可利用CaCl2在碱性条件下与H2O2反应制得。某化学兴趣小组在实验室制备CaO2的实验方案和装置示意图如下:
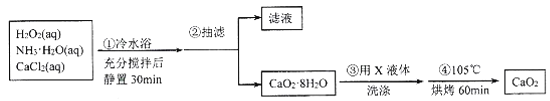

(1)三颈烧瓶中发生的主要反应的化学方程式为___________。
(2)冷水浴的目的是__;步骤③中洗涤CaO2·8H2O的实验操作方法是__
Ⅱ.CaO2含量的测定:测定CaO2样品纯度的方法是:称取0.200g样品于锥形瓶中,加入50mL水和15mL2mol·L-lHCl,振荡使样品溶解生成过氧化氢,再加入几滴MnCl2稀溶液,立即用0.0200mol·L-lKMnO4标准溶液滴定到终点,消耗25.00mL标准液。
(3)上述过程中使用稀盐酸而不使用稀硫酸溶解样品的原因是______;滴定前加入MnCl2稀溶液的作用可能是______。
(4)滴定过程中的离子方程式为____,样品中CaO2的质量分数为____。
(5)实验I制得的晶体样品中CaO2含量偏低的可能原因是:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化氢(PH3)是一种剧毒气体,是常用的高效熏蒸杀虫剂,也是一种电子工业原料.
(1)在密闭粮仓放置的磷化铝(AIP)片剂,遇水蒸气放出PH3气体,化学方程式为 ______
(2)利用反应PH3+3HgCl2=P(HgCl)3↓+3HCl,通过测定溶液 ______ 变化,可准确测定空气中微量的PH3;其中HgCl2溶于水,所得溶液几乎不导电,则HgCl2属于 ______ (填“共价”或“离子”)化合物.
(3)工业制备PH3的流程如图1所示:

①亚磷酸属于 ______ 元酸;
②当反应I生成的n(NaH2PO2):n(Na2HPO3)=3:1时,参加反应的n(P4):n(NaOH)= ______ .
(4)用漂白粉可将PH3氧化为H3PO4,化学方程式为 ______ ;含有水蒸气时可加快PH3的氧化过程,用离子方程式表示原因: ______ .
(5)从(4)中的反应产物中回收磷酸氢钙(CaHPO4)的方法如图2:

①试剂X为 ______ (填化学式);
②已知25℃时,H3PO4的Ka1=7.5×10-3、Ka2=6.3×10-8、Ka3=4.4×10-13.
CaHPO4悬浊液pH ______ 7(填“>”、“=”或“<”),通过计算说明理由 ______ .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com