
 ,氯化铵属于强酸弱碱盐,铵根离子水解导致溶液呈酸性NH4++H20?NH3.H2O+H+,故答案为:
,氯化铵属于强酸弱碱盐,铵根离子水解导致溶液呈酸性NH4++H20?NH3.H2O+H+,故答案为: ;酸性;NH4++H20?NH3.H2O+H+;
;酸性;NH4++H20?NH3.H2O+H+;| 1 |
| 2 |
| 1 |
| 4 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 4 |
| 1 |
| 2 |


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
| A、中和滴定实验中的锥形瓶使用前应该用待装液洗涤 |
| B、用25 mL滴定管进行滴定实验时,消耗某溶液体积为21.70 mL |
| C、在托盘天平的托盘上各垫一张洁净的纸片直接称量NaOH固体 |
| D、用广泛pH试纸测得某溶液的pH为2.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、反应开始到10s,用Z表示的反应速率为0.158mol/(L?s) |
| B、反应开始到10s,X的物质的量浓度减少了0.79mol/L |
| C、反应开始到10s时,Y转化了0.79mol |
| D、反应的化学方程式为:X(g)+Y(g)?Z(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
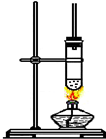 1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反 应装置如图.下列对该实验的描述错误的是( )
1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反 应装置如图.下列对该实验的描述错误的是( )| A、不能用水浴加热 |
| B、长玻璃管起冷凝回流作用 |
| C、提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤 |
| D、浓硫酸的作用是催化剂和吸水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可用托盘天平和称量纸称取10.2g NaOH |
| B、某实验需要900ml 0.1mol/L的硫酸铜溶液,则配制该溶液需称取22.5g胆矾晶体 |
| C、用10 mL量筒量取5.2 mL硫酸,仰视时实际量得的液体体积大于5.2 mL |
| D、焰色反应实验中,连续做两个样品时,应将铂丝用硫酸洗净并灼烧到无特殊焰色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
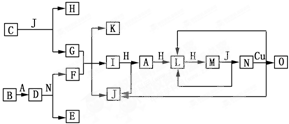
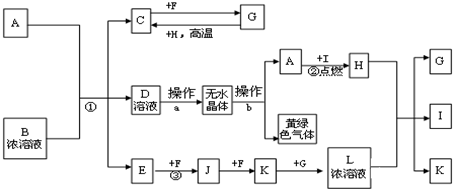
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 氢氧化钡的体积/mL | 硫酸氢钠的体积/mL | 溶液的PH |
| ① | 33.00 | 0.00 | 8 |
| ② | 33.00 | X | 7 |
| ③ | 33.00 | 33.00 | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原混合溶液中c(K+)为4 mol?L-1 |
| B、上述电解过程中共转移1 mole- |
| C、电解得到的Cu的物质的量为1 mol |
| D、电解后溶液中c(H+)为4 mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com