
V��W��X��Y��Z�������ֶ�����Ԫ���е����ֻ�������ɵ�5�ֻ��������W��X��Z��������Ԫ����ɣ�X�ǵ�������ЧӦ����Ҫ���壬Z����Ȼ������Ҫ�ɷ֣�Y��W���������ᷴӦ��������ǿ����Һ��Ӧ������5�ֻ������漰������Ԫ�ص�ԭ������֮�͵���28��V��һ�ֽ���Ԫ�غ����ַǽ���Ԫ����ɣ���ԭ�Ӹ�����Ϊ1�U3�U9������ԭ����������������н���Ԫ�ص�ԭ������������֮��ķ�Ӧ��ϵ����ͼ��

��1��д��W���ʵ�һ����; ��
��2��д��V������NaOH��Һ��Ӧ�Ļ�ѧ����ʽ ��
��3����������Xͨ��ij�����ʵ�ˮ��Һ�п�������Y���÷�Ӧ�����ӷ���ʽΪ ��
��4��4 g Z��ȫȼ������X��Һ̬ˮ�ų�222.5 kJ����������д����ʾZȼ���ȵ��Ȼ�ѧ����ʽ ��
��5����200 mL 1.5 mol��L-1 NaOH��Һ��ͨ���״����4.48 L X���壬��ȫ��Ӧ��������Һ�У���������Ũ���ɴ�С��˳���� ��
��6��Y��һ���������ʣ����ܶȻ�����Ϊ1.25��10-33����0.01 mol YͶ��1 LijŨ�ȵ������У�ΪʹY��ȫ�ܽ�õ���������Һ���������Ũ������ӦΪ ������仯���Բ��ƣ����������λ��Ч���֣���

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016�����Ĵ�ѧ������ѧ������ѧ�ڵ������¿����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
���ݵ���������Ӧ���Ȼ�ѧ����ʽ
��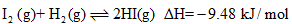
��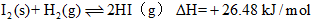
�����ж���ȷ����
A��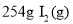 ��ͨ��
��ͨ��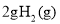 ����Ӧ����9.48 kJ
����Ӧ����9.48 kJ
B��1 mol��̬����1 mol��̬���������������17��00 kJ
C����Ӧ�ٵIJ���ȷ�Ӧ�ڵIJ����ȶ�
D����Ӧ�ڵķ�Ӧ���������ȷ�Ӧ�ٵķ�Ӧ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ���Ϻ��и߶���ѧ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
ȷ��ȡ6 g��������Ʒ(��Al2O3��Fe2O3��SiO2)����ʢ��100 mLijŨ��������Һ���ձ��У���ַ�Ӧ����ˣ�����Һ�м���10 mol��L-l��NaOH��Һ�������ij�������m������NaOH��Һ�����V�Ĺ�ϵ��ͼ��ʾ��������������Һ�����ʵ���Ũ��Ϊ

A��3��50mol��L B��1��75mol��L C��0��85mol��L D��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016������������ѧ������ѧ�ڵ��Ĵ��¿���ѧ�Ծ��������棩 ���ͣ������
����ƽ�ⳣ���Ǻ���������ʵ���̶ȵ�������֪���±����ݣ�25 �棩��
��ѧʽ | ����ƽ�ⳣ�� |
HCN | K��4.9��10��10 |
CH3COOH | K��1.8��10��5 |
H2CO3 | K1��4.4��10��7��K2��4.7��10��11 |
��1��25 ��ʱ����Ũ�ȵ�������Һ(A��NaCN��Һ��B��Na2CO3��Һ��C��CH3COONa��Һ)��pH�ɴ�С��˳��Ϊ________________________________��(��д���)
��2��25 ��ʱ����NaCN��Һ��ͨ������CO2����������Ӧ�Ļ�ѧ����ʽΪ______ ___��
��3������Ũ��Ϊ0.02 mol/L��HCN��0.01mol/L NaOH�������Ϻ��c(Na+)>c(CN-)�����й�ϵ��ȷ���� ��
A��c(H+)>c(OH-)
B��c(H+)<c(OH-)
C��c(H+)+c(HCN) = c(OH-)
D��c(HCN)+ c(CN-)=0.01mol/L
��4��Ũ��Al2(SO4)3��Һ��Ũ��С�մ�(NaHCO3)��Һ��Ͽ���������������ӷ�Ӧ����ʽ��ʾ����ԭ��_____________________��
��5����֪NaHC2O4ˮ��Һ�����ԣ���д������Һ�и�����Ũ�ȵĴ�С___________________������غ����ʽ ___________________ ��
��6��H2C2O4��Һ��KMnO4������Һ�ɷ�����Ӧ��H2C2O4��MnO4-��H����CO2��Mn2����H2O����Ӧ��ÿ���ɱ����4.48LCO2���壬���·��ͨ���ĵ��ӵ����ʵ���Ϊ__________mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016������������ѧ������ѧ�ڵ��Ĵ��¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��NAΪ����٤��������ֵ������˵����ȷ���ǣ� ��
A�����ܱ������м���l.5mol H2��0.5molN2����ַ�Ӧ��ɵõ�NH3������ΪNA
B��100ml 1mol/L��FeCl3��Һ��Fe3+��ĿΪ0.1NA
C����״���£�22.4L��CCl4�к��е�CCl4������ΪNA
D�����³�ѹ�£�92g��NO2��N2O4������庬�е�ԭ����Ϊ6NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�캣��ʡ����У���˸�����һ��������ѧ���������棩 ���ͣ��ƶ���
��֪A��һ����Է�������Ϊ28 ����̬��������ת��Ϊ���������л��ת����ϵ��ͼ��ʾ��
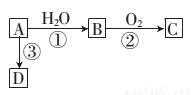
��ش��������⣺
��1��д��A �Ľṹ��ʽ��_______��
��2����Ӧ�ٵķ�Ӧ����Ϊ_______��
��3��B��C��ת����ͨ����ͭ������������д��ת���Ļ�ѧ����ʽ��_______��
��4��D��һ�־ۺ�����������ϲ�Ʒ����ṹ��ʽΪ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ���㽭��Ҧ��ѧ��һ��ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���з�Ӧ����������ԭ��Ӧ����ˮ�Ȳ���������Ҳ������ԭ������
A��CaO + H2O = Ca(OH)2
B��2F2 + 2H2O = 4HF + O2
C��Cl2 + H2O = HCl + HClO
D��2Na + 2H2O = 2NaOH + H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ��ɽ����ѧ������ѧ��һ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʵ���У���pH��ֽ��ʹ�� �ڹ��� ������ ������һ�����ʵ���Ũ����Һ�����õ���������
A�������� B�������� C���Թ� D����Һ©��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ���Ĵ�ʡ�߶������п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪�����Ȼ�ѧ����ʽ��
��CH3COOH(l)��2O2(g)===2CO2(g)��2H2O(l) ��H1����870.3 kJ/mol��
��C(s)��O2(g)===CO2(g) ��H2����393.5 kJ/mol��
��H2(g)��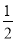 O2(g)===H2O(l) ��H3����285.8 kJ/mol��
O2(g)===H2O(l) ��H3����285.8 kJ/mol��
��Ӧ2C(s)��2H2(g)��O2(g)===CH3COOH(l)�Ħ�HΪ( )
A����488.3 kJ/mol
B����244.15 kJ/mol
C����488.3 kJ/mol
D����244.15 kJ/mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com