
电离平衡常数是衡量弱电解质电离程度的量。已知如下表数据(25 ℃):
化学式 | 电离平衡常数 |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
(1)25 ℃时,等浓度的三种溶液(A.NaCN溶液、B.Na2CO3溶液、C.CH3COONa溶液)的pH由大到小的顺序为________________________________。(填写序号)
(2)25 ℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为______ ___。
(3)现有浓度为0.02 mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是 。
A.c(H+)>c(OH-)
B.c(H+)<c(OH-)
C.c(H+)+c(HCN) = c(OH-)
D.c(HCN)+ c(CN-)=0.01mol/L
(4)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理_____________________。
(5)已知NaHC2O4水溶液显酸性,请写出该溶液中各离子浓度的大小___________________;电荷守恒表达式 ___________________ 。
(6)H2C2O4溶液和KMnO4酸性溶液可发生反应:H2C2O4+MnO4-+H+→CO2+Mn2++H2O,反应中每生成标况下4.48LCO2气体,外电路中通过的电子的物质的量为__________mol。
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源:2015-2016学年四川省高二上10月月考化学试卷(解析版) 题型:填空题
五种短周期元素A、B、C、D、E,原子序数逐渐增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子数多3个。E周期序数等于E原子最外层电子数。根据以上信息回答下列问题:
(1)A、B、C、D、E五种元素的原子半径由小到大的顺序是 (用元素符号填写)
(2)乙物质中存在的化学键类型是 。
(3)选用恰当的试剂除去D中少量的E,写出发生反应的化学方程式
(4)化合物乙的电子式
(5)将D、E的单质插入NaOH溶液中,构成原电池,其负极反应是
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省黄石市高一上11月期中月考化学试卷(解析版) 题型:选择题
今有一种固体化合物X,X本身不导电,但在熔融状态下或溶于水中均能够电离,下列关于X的说法中,正确的是
A.X一定为电解质
B.X可能为非电解质
C.X只能是盐类
D.X只能是碱类
查看答案和解析>>
科目:高中化学 来源:2015-2016学年上海市高二上学期期中测试化学试卷(解析版) 题型:选择题
三种非金属元素X、Y、Z,它们的原子半径由小到大的顺序为X<Y<Z,则下列判断中正确的是
A.非金属性X<Y<Z
B.气态氢化物的热稳定性按X、Y、 Z顺序减弱
C.X、Y、Z的最高价氧化物对应水化物酸性由弱到强
D.X、Y、Z最外层电子数依次增大
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三11月月考化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.任何化学反应都伴随着能量变化
B.放热反应的反应速率总是大于吸热反应的反应速率
C.离子化合物中一定含有离子键,可能含有共价键
D.强 电解质与弱电解质的区别就是电解质在水溶液中是否完全电离
电解质与弱电解质的区别就是电解质在水溶液中是否完全电离
查看答案和解析>>
科目:高中化学 来源:2016届宁夏育才中学高三上学期第四次月考化学试卷(解析版) 题型:选择题
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的顺序为SO2>I-> Fe2+>H2O2>Cl-,则下列反应不可能发生的是( )
A.2Fe3++SO2+2H2O = 2Fe2++SO42- +4H+ B.I2+SO2+2H2O = H2SO4+2HI
C.2Fe2++I2 = 2Fe3++2I- D.H2O2+SO2 = H2SO4
查看答案和解析>>
科目:高中化学 来源:2016届湖北武汉华中师大一附中等八校高三上联考一理化学卷解析版 题型:推断题
V、W、X、Y、Z是由四种短周期元素中的两种或三种组成的5种化合物,其中W、X、Z均由两种元素组成,X是导致温室效应的主要气体,Z是天然气的主要成分,Y、W都既能与酸反应,又能与强碱溶液反应。上述5种化合物涉及的四种元素的原子序数之和等于28;V由一种金属元素和两种非金属元素组成,其原子个数比为1︰3︰9,所含原子总数等于其组成中金属元素的原子序数。它们之间的反应关系如下图:

(1)写出W物质的一种用途 。
(2)写出V与足量NaOH溶液反应的化学方程式 。
(3)将过量的X通入某种物质的水溶液中可以生成Y,该反应的离子方程式为 。
(4)4 g Z完全燃烧生成X和液态水放出222.5 kJ的热量,请写出表示Z燃烧热的热化学方程式 。
(5)在200 mL 1.5 mol·L-1 NaOH溶液中通入标准状况下4.48 L X气体,完全反应后所得溶液中,各种离子浓度由大到小的顺序是 。
(6)Y是一种难溶物质,其溶度积常数为1.25×10-33。将0.01 mol Y投入1 L某浓度的盐酸中,为使Y完全溶解得到澄清透明溶液,则盐酸的浓度至少应为 (体积变化忽略不计,结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江台州中学高二上第三次统练化学试卷(解析版) 题型:选择题
2 mol的PCl3和1 mol的Cl2混合后充入容积不变的密闭容器中,在一定条件下发生反应: PCl3(g)+Cl2(g)  PCl5(g),达到平衡时,PCl5为0.4 mol。如果此时移走1 mol PCl3 和0.5 mol Cl2,在相同温度下再次达到平衡时,PCl5的物质的量( )
PCl5(g),达到平衡时,PCl5为0.4 mol。如果此时移走1 mol PCl3 和0.5 mol Cl2,在相同温度下再次达到平衡时,PCl5的物质的量( )
A.等于0.4 mol B.等于0.2 mol C.小于0.2 mol D.大于0.2 mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三化学一诊模拟理综化学试卷(解析版) 题型:简答题
某NiO的废料中有FeO、CuO、Al2O3、MgO、SiO2等杂质,用此废料提取NiSO4和Ni的流程如下:
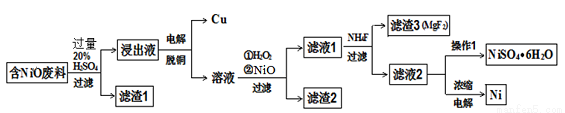
已知:有关金属离子生成氢氧化物沉淀所需的pH如下表:

(1)滤渣1的主要成分为 。
(2)从滤液2中获得NiSO4.6H2O的实验操作 、 、过滤、洗涤、干燥。
(3)用离子方程式解释加入H2O2的作用 。
(4)加NiO调节溶液的pH至5,则生成沉淀的离子方程式有 。
(5)电解浓缩后的滤液2可获得金属镍,其基本反应原理如图:
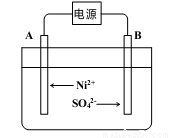
①A电极反应式为 和2H++2e- =H2↑。
②若一段时间后,在A、B两极均收集到11.2L气体(标准状况下),能得到Ni g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com