
【题目】在下列给定的溶液中,一定能大量共存的离子组是( )
A.过量Al与NaOH溶液反应所得溶液中:K+、Cl-、Al3+、SO42-
B.常温下,OH-的浓度为10-11mol/L的溶液中:Na+、I-、NH4+、NO3-
C.常温下, ![]() =0.1molL1的溶液中:K+、NH4+、Cl-、SO42-
=0.1molL1的溶液中:K+、NH4+、Cl-、SO42-
D.与Al反应产生H2的溶液中:K+、Na+、Cl-、NO3-
【答案】C
【解析】A.过量Al与NaOH溶液反应所得溶液,显碱性,不能大量存在Al3+ , A不符合题意;
B.常温下,OH-的浓度为10-11mol/L的溶液,溶液显酸性,H+、I-、NO3-发生氧化还原反应,不能大量共存,B不符合题意;
C.常温下, ![]() =0.1molL1的溶液,溶液显酸性,该组离子之间不反应,可大量共存,C符合题意;
=0.1molL1的溶液,溶液显酸性,该组离子之间不反应,可大量共存,C符合题意;
D.与Al反应产生H2的溶液,为非氧化性酸或强碱溶液,酸性溶液中Al、NO3-发生氧化还原反应不生成氢气,D不符合题意;
故答案为:CA.反应后溶液中存在AlO2-;
B.限定条件下溶液显酸性;
C.根据常温下Kw=1.0×10-14判断溶液的酸碱性;
D.限定条件下,溶液可能显酸性,也可能显碱性;


科目:高中化学 来源: 题型:
【题目】将等物质的量的X、Y气体充入一个容积可变的密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g) ![]() 3Z(g) △H<0。当改变某个条件并维持新条件直至达到新平衡,下表中关于新平衡与原平衡的比较,正确的是( )
3Z(g) △H<0。当改变某个条件并维持新条件直至达到新平衡,下表中关于新平衡与原平衡的比较,正确的是( )
选择 | 改变的条件 | 正、逆反应速率变化 | 新平衡和原平衡比较 |
A | 增大压强 | 正、逆反应速率都增大量 | Z的浓度减小 |
B | 充入少量Z | 逆反应速率增大 | X的体积分数不变 |
C | 充入少量Z | v(逆)>v(正) | Z的浓度减小 |
D | 升高温度 | 逆反应速率增大量大于 | Z的体积分数变大 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,两个恒容密闭容器中分别发生下列两个反应:①H2(g)+I2(g) ![]() 2HI(g) ②C(s)+H2O(g)
2HI(g) ②C(s)+H2O(g) ![]() CO(g)+H2(g),下列状态能表明两反应都达到平衡状态的是( )
CO(g)+H2(g),下列状态能表明两反应都达到平衡状态的是( )
a.各物质的浓度不变
b.容器内气体压强不变
c.容器内气体密度不变
d.容器内气体颜色不变
e.各组分的物质的量分数或质量分数不变
A.abc
B.ade
C.ac
D.ae
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列自发反应可用焓判据来解释的是( )
A. 氢氧化钡和氯化铵的反应
B. 2N2O5(g)![]() 4NO2(g)+O2(g) H=+56.7 kJ/mol
4NO2(g)+O2(g) H=+56.7 kJ/mol
C. (NH4)2CO3(s)![]() NH4HCO3(s)+NH3(g) H=+74.9 kJ/mol
NH4HCO3(s)+NH3(g) H=+74.9 kJ/mol
D. 2H2(g)+O2(g)![]() H2O(l) H=-285.8 kJ/mol
H2O(l) H=-285.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂空气充电电池有望成为电动汽车的实用储能设备。工作原理示意图如下,下列叙述正确的是
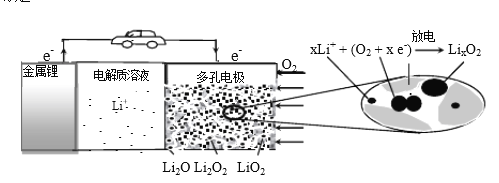
A. 该电池工作时Li+向负极移动
B. Li2SO4溶液可作该电池电解质溶液
C. 电池充电时间越长,电池中Li2O 含量越多
D. 电池工作时,正极可发生: 2Li+ +O2+ 2e-=Li2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置,A、B中电极为多孔的惰性电极;C、D为夹在湿的Na2SO4滤纸条上的铂夹;电源有a、b两极.若A、B中充满KOH溶液后倒立于KOH溶液的水槽中.切断K1 , 合闭K2、K3通直流电,回答下列问题: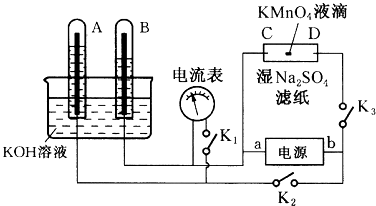
(1)判断电源的两极,a为极。
(2)在湿的Na2SO4溶液滤纸条中心的KMnO4液滴,过一段时间,现象为。
(3)若电解一段时间后,A、B中均有气体包围电极.此时切断K2、K3 , 合闭K1 , 则电流表的指针(填是或否)偏转;若偏转,则此时A极电极反应式为。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com