
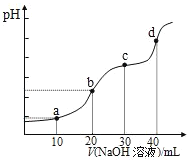
【题目】25℃时,向20mL0.1mol/LH2R溶液中滴加0.1mol/LNaOH溶液,溶液的pH随NaOH溶液体积的变化如图所示。已知pKa = –lgKa,二元弱酸H2R的pKa1=1.89,pKa2=7.21.下列有关说法错误的是
A.H2R + R22HR平衡常数K>105,反应趋于完全
B.常温下,Kh(HR-)的数量级为10-13
C.点b时,pH<7且 c(R2)·c(H+)<c(H2R)·c(OH)
D.点c时,溶液中2c(OH)-2c(H+)=3c(H2R)+ c(HR)-c(R2)
【答案】C
【解析】
A.pKa = –lgKa,二元弱酸H2R的pKa1=1.89,pKa2=7.21,Ka1= =10-1.89,Ka2=
=10-1.89,Ka2=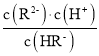 =10-7.21,H2R + R22HR平衡常数K=
=10-7.21,H2R + R22HR平衡常数K=![]() =
=![]() =105.32>105, K越大,表示反应正向进行的程度越大,则反应趋于完全,故A正确;
=105.32>105, K越大,表示反应正向进行的程度越大,则反应趋于完全,故A正确;
B.常温下,Kh(HR-)=![]() =10-12.11,则Kh(HR-)数量级为10-13,故B正确;
=10-12.11,则Kh(HR-)数量级为10-13,故B正确;
C.b点二者恰好完全反应生成NaHR,Ka1=107.21>Kh=![]() ,溶液呈酸性,即pH <7,且
,溶液呈酸性,即pH <7,且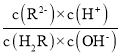 =
=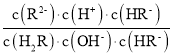 =
=![]() =
=![]() =104.9>1,即c(R2)·c(H+)>c(H2R)·c(OH),故C错误;
=104.9>1,即c(R2)·c(H+)>c(H2R)·c(OH),故C错误;
D.c点溶液溶质为等物质的量的Na2R、NaHR,Na2R溶液中存在质子守恒:c(OH)= c(HR)+2c(H2R)+ c(H+),NaHR溶液中存在质子守恒:c(OH)+ c(R2)= c(H2R)+ c(H+),两个溶液混合后,两式合并,质子守恒式为:2c(OH)+c(R2)=3c(H2R)+ c(HR)+2c(H+),则2c(OH)-2c(H+)=3c(H2R)+ c(HR)-c(R2),故D正确;
答案选C。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】有以下物质:①![]() 、②
、②![]() 、③
、③![]() 、④
、④![]() 、⑤
、⑤![]() 、⑥
、⑥![]() 、⑦
、⑦![]() 、⑧
、⑧![]() 和⑨
和⑨![]() 。
。
(1)只含有![]() 键的是__________(填序号,下同);
键的是__________(填序号,下同);
(2)既含有![]() 键又含有
键又含有![]() 键的是__________。
键的是__________。
(3)含有由两个原子的![]() 轨道重叠形成
轨道重叠形成![]() 键的是__________。
键的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组用如图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。
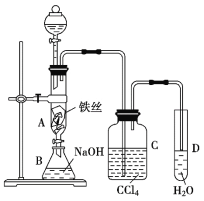
(1)反应后观察到A中反应液微沸,有红棕色气体充满A容器,写出A中反应的化学方程式__;
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是__;
(3)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入__溶液,若产生淡黄色沉淀,则能证明。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SiH4是一种无色的气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O,已知室温下2gSiH4自燃放出热量89.2kJ,其热化学方程式为:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有Na2CO3、NaAlO2的混合溶液中逐滴加入150 mL 1 mol L-1的HC1溶液,测得溶液中某几种离子的物质的量的变化情况如图所示。下列说法不正确的是
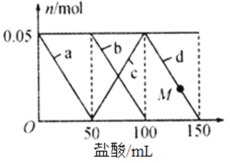
A.b和c曲线表示的离子反应均为CO32-+H+= HCO3-
B.结合H+的能力:AlO2>CO32> HCO3>Al(OH)3
C.原混合溶液中,CO32与AlO2的物质的量之比为2∶1
D.M点时A1(OH)3的质量等于3.9 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是A、B、C、D、E五种短周期元素的某些性质,下列判断正确的是( )
元素 | A | B | C | D | E |
最低化合价 | -4 | -2 | -1 | -2 | -1 |
电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
A.C、D、E的简单氢化物的稳定性:C>D>E
B.元素A的原子最外层中无自旋状态相同的电子
C.元素B、C之间不可能形成化合物
D.与元素B同周期且在该周期中第一电离能最小的元素的单质能与![]() 发生置换反应
发生置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z、Q、E、M、G原子序数依次增大的七种元素,除G元素外其余均为短周期主族元素。X元素原子中没有成对电子,Y元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子数相同,Z元素原子的价电子排布式为![]() ,Q元素基态原子核外成对电子数足未成对电子数的 3倍,E与Q位于同周期,M元素的第一电离能在 同周期主族元素中排第三位,G元素原子的价电子 排布式为
,Q元素基态原子核外成对电子数足未成对电子数的 3倍,E与Q位于同周期,M元素的第一电离能在 同周期主族元素中排第三位,G元素原子的价电子 排布式为![]() 。回答下列问题:
。回答下列问题:
(1)写出第3周期基态原子未成对电子数与G的相同且电负性最大的元素: ___________ (填元素名称)。GQ受热分解生成![]() 和
和![]() ,请从G的原子结构来说明
,请从G的原子结构来说明![]() 受热易分解的原因: ______ 。
受热易分解的原因: ______ 。
(2) Z、Q、M三种元素的第一电离能由大到小的顺序为 _________ (用元素符号表示)。
(3) Y与Q形成原子个数比为1:2的化合物的电子式为 _________ 。
(4) Z、M、E所形成的简单离子的半径由大到小的顺序为 __________ (用离子符号表示)。
(5) X、Y、Z、Q的电负性由大到小的顺序为 _______ (用元素符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I-具有还原性,含碘食盐中的碘元素主要以KIO3的形式存在,I-、I2、IO3-在一定条件下可发生如图转化关系,下列说法不正确的是

A.用淀粉-KI试纸和食醋可检验食盐是否加碘
B.由图可知氧化性的强弱顺序为Cl2>IO3->I2
C.生产等量的碘,途径I和途径II转移电子数目之比为5 :2
D.途径III反应的离子方程式:3Cl2+I-+3H2O=6Cl-+IO3-+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某无机化合物的二聚分子结构示意图,该分子中A、B两种元素都是第3周期的元素,分子中所有原子的最外层都达到8个电子的稳定结构。下列说法不正确的是( )
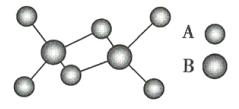
A.该物质的化学式是Al2Cl6B.该物质是离子化合物,在熔融状态下能导电
C.该物质在固态时所形成的晶体是分子晶体D.该物质中不存在离子键,也不含有非极性键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com