【答案】
分析:Ⅰ.A、催化氧化阶段的反应是SO
2被氧气氧化为SO
3;
B、电解氯化镁溶液得不到Mg;
C、普通水泥的主要成分是硅酸二钙、硅酸三钙、铝酸三钙;
D、黏土的主要成分二氧化硅,还有氧化镁、碳酸钙和三氧化二铝;
Ⅱ.(1)根据难挥发性酸制备挥发性酸的原理,浓硫酸与氯化钠晶体反应生成HCl气体,硫酸钠和焦炭、石灰石反应的产物之一为CaS,说明发生了氧化还原反应,S元素的化合价降低,Na
2SO
4作氧化剂,则作还原剂的为焦炭,C元素的化合价升高为+4价,由此可判断产物还有碳酸钠和二氧化碳;
(2)中间产物C是Ca(OH)
2,D是NH
3;化学方程式为CO
2+H
2O+NH
3=NaHCO
3↓+NH
4Cl;
(3)能提高原料的利用率,减少废渣(CaCl
2)的排放,保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高; NH
4Cl 可做氮肥;可与合成氨厂联合,使合成氨的原料气 CO 转化成 CO
2,革除了 CaCO
3 制 CO
2 这一工序;
(4)不可行.因为KHCO
3和NH
4Cl的溶解度相差不大,当温度高于40℃时,KHCO
3的溶解度大于NH
4Cl,降温结晶时会析出较多的KCl.
解答:解:Ⅰ.A、催化氧化阶段的反应是SO
2被氧气氧化为SO
3,故A正确;
B、电解氯化镁溶液得不到Mg,故B错误;
C、普通水泥的主要成分是硅酸二钙、硅酸三钙、铝酸三钙,故C错误;
D、黏土的主要成分二氧化硅,还有氧化镁、碳酸钙和三氧化二铝,故D错误;
故选A;
Ⅱ.(1)根据难挥发性酸制备挥发性酸的原理,浓硫酸与氯化钠晶体反应生成HCl气体,反应方程式为:2NaCl+H
2SO
4(浓)
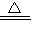
Na
2SO
4+2HCl↑;硫酸钠和焦炭、石灰石反应的产物之一为CaS,说明发生了氧化还原反应,S元素的化合价降低,Na2SO4作氧化剂,则作还原剂的为焦炭,C元素的化合价升高为+4价,由此可判断产物还有碳酸钠和二氧化碳,其反应方程式为Na
2SO
4+2C+CaCO
3
CaS+Na
2CO
3+CO
2↑;
故答案为:2NaCl+H
2SO
4(浓)
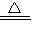
Na
2SO
4+2HCl↑,Na
2SO
4+2C+CaCO
3
CaS+Na
2CO
3+CO
2↑
(2)①甲装置为煅烧石灰石生成氧化钙和二氧化碳的装置,生成的氧化钙与水反应生成氢氧化钙,所以C应为Ca(OH)
2,Ca(OH)
2加入到丁装置,与NH
4Cl反应生成NH
3,则D应为NH
3;故答案为:中间产物C是Ca(OH)
2,D是NH
3;
②在溶液中足量的CO
2和H
2O及NH
3会生成HCO
3-,HCO
3-再与Na
+结合生成NaHCO
3晶体,以沉淀的形式析出,故答案为:NaCl+CO
2+H
2O+NH
3=NaHCO
3↓+NH
4Cl
(3)该方法能提高原料的利用率,减少废渣的排放,保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高;NH
4Cl 可做氮肥;可与合成氨厂联合,使合成氨的原料气 CO 转化成 CO
2,革除了 CaCO
3 制 CO
2 这一工序.
故答案为:能提高原料的利用率,减少废渣(CaCl
2)的排放,保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高;
NH
4Cl 可做氮肥;
可与合成氨厂联合,使合成氨的原料气 CO 转化成 CO
2,革除了 CaCO
3 制 CO
2 这一工序.
(4)由溶解曲线图可知KHCO
3和NH
4Cl的溶解度相差不大,当温度高于40℃时,由图象可知,降温结晶时会析出较多的KCl;
故答案为:不可行.因为KHCO
3和NH
4Cl的溶解度相差不大,当温度高于40℃时,KHCO
3的溶解度大于NH
4Cl,降温结晶时会析出较多的KCl.
点评:本题以工艺流程为依托,综合考查了离子反应,氧化还原反应,物质的溶解性,化学实验等知识,综合性较强.

 2SO3(g)△H<0
2SO3(g)△H<0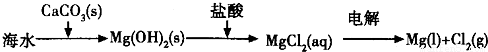
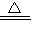 Na2SO4+2HCl↑;硫酸钠和焦炭、石灰石反应的产物之一为CaS,说明发生了氧化还原反应,S元素的化合价降低,Na2SO4作氧化剂,则作还原剂的为焦炭,C元素的化合价升高为+4价,由此可判断产物还有碳酸钠和二氧化碳,其反应方程式为Na2SO4+2C+CaCO3
Na2SO4+2HCl↑;硫酸钠和焦炭、石灰石反应的产物之一为CaS,说明发生了氧化还原反应,S元素的化合价降低,Na2SO4作氧化剂,则作还原剂的为焦炭,C元素的化合价升高为+4价,由此可判断产物还有碳酸钠和二氧化碳,其反应方程式为Na2SO4+2C+CaCO3 CaS+Na2CO3+CO2↑;
CaS+Na2CO3+CO2↑;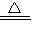 Na2SO4+2HCl↑,Na2SO4+2C+CaCO3
Na2SO4+2HCl↑,Na2SO4+2C+CaCO3 CaS+Na2CO3+CO2↑
CaS+Na2CO3+CO2↑

 名校课堂系列答案
名校课堂系列答案