
分析 (1)甲烷为四面体结构,mCH4•nH2O为分子晶体;
(2)1g甲烷完全燃烧生成液态水放出55.64kJ热量,可计算1mol甲烷燃烧放出的热量;
(3)甲烷分解需要热量,燃烧可提供部分能量;
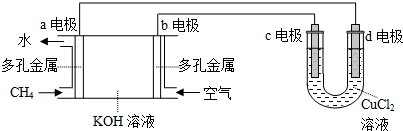
(4)①a极通的是燃料甲烷,所以是负极;
②d电极与电源的负极相连是阴极,铜离子放电,生成单质铜,电极反应式为Cu2++2e-=Cu;
③假设CuCl2溶液足量,当某电极上析出3.2g金属Cu时,结合电极方程式确定整个电路转移的物质的量,以此可计算消耗氧气的物质的量,进而计算体积.
解答 解:(1)甲烷为四面体结构,mCH4•nH2O的熔沸点较低,为分子晶体,故答案为:正四面体; 分子;
(2)1g甲烷完全燃烧生成液态水放出55.64kJ热量,则1mol甲烷燃烧放出的能量为16×55.64=890.24,故答案为:-890.24;
(3)甲烷分解需要热量,燃烧可提供部分能量,故答案为:提供甲烷分解所需的能量;
(4)①a极通的是燃料甲烷,所以是负极,故答案为:负极;
②d电极与电源的负极相连是阴极,铜离子放电,生成单质铜,电极反应式为Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
③假设CuCl2溶液足量,当某电极上析出3.2g金属Cu时,整个电路转移的物质的量为:$\frac{3.2g}{64g/mol}$×2=0.05mol×2=0.1mol,消耗氧气的物质的量为:$\frac{0.05mol}{4}$×2=0.025mol,所以需氧气的体积为0.025mol×22.4L/mol=0.56L,所以空气的体积为$\frac{0.56L}{20%}$=2.8L,故答案为:2.8.
点评 本题综合考查法反应热与焓变以及原电池原理,为高频考点,明确原电池正负极的判断方法是解本题关键,原电池原理是高中化学的重点也是难点,要注意掌握原电池原理,把握本质,正确书写电极反应方程式,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol苯酚中“C═C”的个数为3 NA | |
| B. | 常温常压下,22.4L丙烷所含有的共价键数目为10NA | |
| C. | 标准状况下,1L戊烷充分燃烧后生成的气态产物的分子数为$\frac{5}{22.4}$ NA | |
| D. | 2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | V1=20mL,V2>20mL | |
| B. | A点之后至B点之前的溶液中,一定是:c(X- )>c( Na+)>c(H+)>c(OH- ) | |
| C. | 若V1=10mL,C点的溶液中,一定是:c(HY )-c( Y-)=2[c(OH- )-c(H+)] | |
| D. | D点以后的溶液中,一定是:c( Na+)>c(OH- )>c(Y- )>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
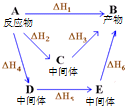
| A. | 组成为C4H8的化合物性质都相同 | |
| B. | 氢弹原料D、T,可由${\;}_1^1$H在化学反应中制取 | |
| C. | 粗铜电解精炼时,阳极减少的质量一定等于阴极增加的质量 | |
| D. | 图中物质A经不同途径生成B时,焓变满足:△H1=△H2+△H3=△H4+△H5+△H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
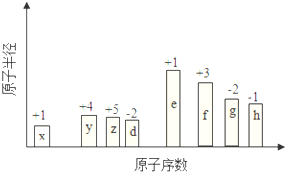 随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.
随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.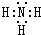 .位于第四周期且与z同主族的元素,其气态氢化物的化学式为AsH3.
.位于第四周期且与z同主族的元素,其气态氢化物的化学式为AsH3.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期元素Q、R、T、W在元素周期表中位置如图所示,其中T所处的周期序数与主族序数相等,
短周期元素Q、R、T、W在元素周期表中位置如图所示,其中T所处的周期序数与主族序数相等, ,R的最简单氢化物的电子式为
,R的最简单氢化物的电子式为 ,Q的1:1型氢化物中相对分子质量最小的分子是直线型分子(立体构型).
,Q的1:1型氢化物中相对分子质量最小的分子是直线型分子(立体构型).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
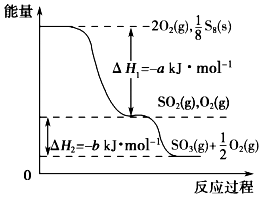 在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)(已知:2SO2+O2?2SO3),反应过程中的能量关系可用如图简单表示(图中的△H 表示生成1mol产物的数据). 下列说法正确的是( )
在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)(已知:2SO2+O2?2SO3),反应过程中的能量关系可用如图简单表示(图中的△H 表示生成1mol产物的数据). 下列说法正确的是( )| A. | S8的燃烧热△H=-a kJ•mol-1 | |
| B. | 1 mol SO2和过量 O2反应可释放出 b kJ 的热量 | |
| C. | 已知1个S8分子中有8个S-S,S=O的键能为d kJ•mol-1,O=O的键能为e kJ•mol-1,则S8分子中S-S的键能为(2d-a-e) kJ•mol-1 | |
| D. | 若使用V2O5作催化剂,当SO2(g)转化生成1mol SO3(g)时,释放的热量小于b kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com