

| A. | V1=20mL,V2>20mL | |
| B. | A点之后至B点之前的溶液中,一定是:c(X- )>c( Na+)>c(H+)>c(OH- ) | |
| C. | 若V1=10mL,C点的溶液中,一定是:c(HY )-c( Y-)=2[c(OH- )-c(H+)] | |
| D. | D点以后的溶液中,一定是:c( Na+)>c(OH- )>c(Y- )>c(H+) |
分析 根据图示,0.1mol/L酸的pH等于1的HX是强酸,HY是弱酸,HX+NaOH=NaX+H2O,HY+NaOH=NaY+H2O,NaY溶液显示碱性,根据溶液中的电荷守恒、质子守恒和物料守恒等知识来回答.
解答 解:根据图示,0.1mol/L酸的pH等于1的HX是强酸,HY是弱酸;
A.NaX显示中性,NaY溶液显示碱性,当V1=20mL,此时V2<20mL,故A错误;
B.A点之后至B点之前的溶液显示酸性,此时HX酸剩余,得到HX和NaX的混合物,剩余的酸较多时,存在:c(X- )>c( H+)>c(Na+)>c(OH- ),故B错误;
C.C点的溶液呈酸性,HY过量,NaOH不足,n(NaOH)=$\frac{1}{2}$n(HY),存在电荷守恒:c(Y- )+c(OH-)=c( H+)+c(Na+),物料守恒:c(HY )+c( Y-)=2c(Na+),则二者联式可得c(HY )-c( Y-)=2[c(OH- )-c(H+)],故C正确;
D.D点以后,如n(NaOH)=(nHY),此时c(Y- )>c(OH- ),故D错误.
故选C.
点评 本题考查离子浓度大小的比较以及酸碱混合的定性判断和计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握电荷守恒、物料守恒的运用,难度中等.


科目:高中化学 来源: 题型:实验题
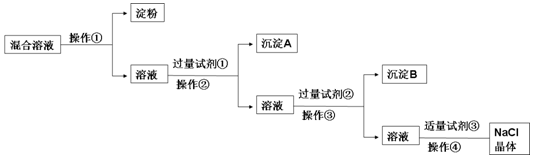
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(SO2)=4mol•L-1•min-1 | B. | V(O2)=3mol•L-1•min-1 | ||
| C. | V(SO3)=0.1mol•L-1•S-1 | D. | V(O2)=0.1mol•L-1•S-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 生成42.0 L N2(标准状况) | |
| B. | 转移电子的物质的量为1.25 mol | |
| C. | 有0.250 mol KNO3被氧化 | |
| D. | 被氧化的N原子的物质的量为3.75 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
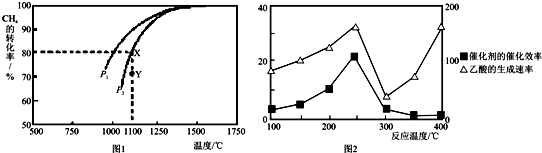
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

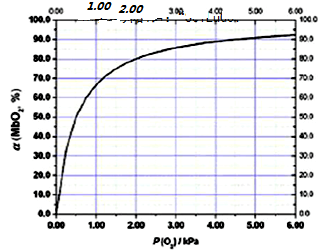
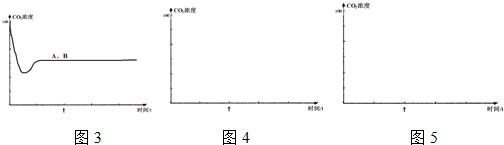
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
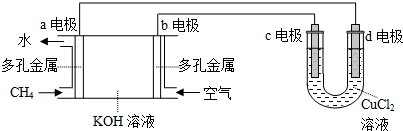
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
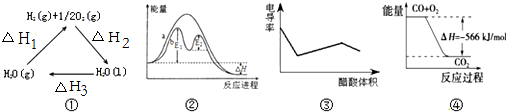
| A. | 图①中△H2=△H1+△H3 | |
| B. | 图②在催化剂条件下,反应的活化能等于E1+E2 | |
| C. | 图③表示醋酸溶液滴定 NaOH 和氨水混合溶液的电导率变化曲线 | |
| D. | 图④可表示由CO(g)生成CO2(g)的过程中要放出566kJ 热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com